作为全球最具权威性的肿瘤学会组织之一,ESMO指南一直是临床工作者的重要参考,ESMO卵巢癌指南在2013年发布后仅于2021年对一线治疗推荐进行了更新1-2,睽违十载,2023《ESMO临床实践指南:新诊断和复发性上皮性卵巢癌的诊断治疗和随访》3(以下简称ESMO指南)再次重磅发布,新版指南基于全球研究进展,对卵巢癌的流行病学、诊断、治疗等进行了系统性阐述,对相关证据经过客观分析并严格按照循证医学标准进行推荐,为临床医生提供了更为全面的指导。本文就ESMO指南中复发卵巢癌治疗策略,尤其是维持治疗方案的选择进行介绍和解读,以期为医务工作者更好的理解和遵循指南提供帮助。
一、World Views on Evidence-Based Medicine
复发卵巢癌的治疗策略
ESMO指南建议复发卵巢癌患者治疗前应进行充分评估,包括组织学类型、BRCA 1/2状态、既往治疗方案和疗效、患者一般情况及个人偏好等。对不适合或不愿继续抗肿瘤治疗者采取最佳支持治疗。接受复发治疗的患者根据是否适合铂化疗进行分层,不适合铂化疗者,标准治疗方案是非铂化疗,包括紫杉醇、多柔比星脂质体等单药或联合贝伐单抗。适合铂化疗的患者如为初次复发且AGO评分阳性可考虑由专业团队进行二次肿瘤细胞减灭术(SCS)。含铂双药化疗±贝伐单抗获得完全或部分缓解者,予以PARP抑制剂或贝伐单抗维持治疗至疾病进展或后线治疗。ESMO指南对复发卵巢癌患者的治疗策略整体上与其他国际权威指南一致,均强调“手术(需评估)+化疗+维持治疗”的综合治疗模式,但在一些具体细节,如铂化疗人群划分、维持治疗方案选择上亦有基于循证证据评估后的不同考量。
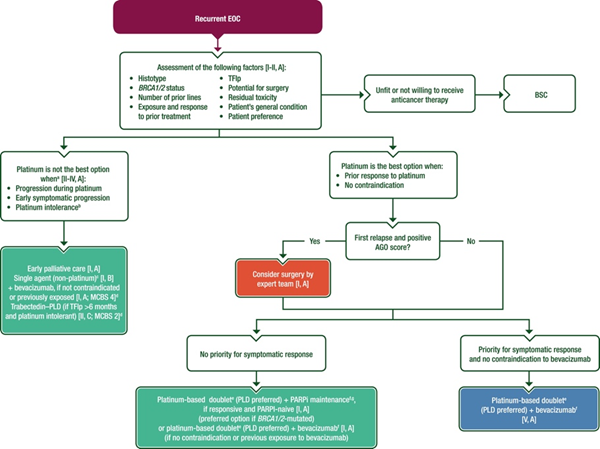
图片来源:2023 ESMO卵巢癌指南
核心解读1:铂化疗适用人群的界定
肿瘤内异质性是阻碍高级别浆液性卵巢癌研究最大的障碍之一4,对复发性卵巢癌,目前尚无分子生物标志物可预测再次使用铂化疗的疗效。根据复发时间与末次使用含铂化疗的时间间隔的不同,可将复发性卵巢癌分为铂难治型、铂耐药型、铂部分敏感型和铂完全敏感型,这种分类具有一定的临床实用性,但也会受患者随访频率及复发检测方法和复发定义的影响5-6,研究发现并非所有无铂间期>6个月的患者对铂化疗均有反应(ORR 47.2%~66%),相反,无铂间期<6个月的患者中也不乏有对铂治疗敏感者7。这种基于无铂间期的敏感性定义在第五届GCIG卵巢癌共识会议期间受到质疑,并于2018年ESGO共识会议后停止使用,据此,ESMO指南采用铂是否为最佳选择(综合评估是否为铂耐药/不耐受、患者偏好及生活质量)来对患者系统治疗方案进行分层。本质上,ESMO指南并非反对铂敏感/耐药的划分,而是希望这种分层是基于对患者个体的综合评估,而非简单的基于日历决策(calendar-based decision)。
核心解读2:PARP抑制剂维持治疗人群
2.1 推荐尼拉帕利和卢卡帕利用于全人群维持治疗
III期临床试验NOVA研究证实尼拉帕利不仅能显著提高gBRCAm患者PFS(21.0个月 vs. 5.5个月,HR 0.27,95% CI 0.17–0.41,p<0.001),也能显著提升gBRCAwt患者PFS(9.3个月 vs. 3.9个月,HR 0.45,95% CI 0.34-0.61,p<0.001)8。虽然最终分析未能观察到OS获益(HR值95% CI跨1)9,但基于主要终点PFS所取得的显著获益以及在中国开展的III期临床试验NORA研究显示的全人群OS获益趋势10,ESMO指南推荐尼拉帕利用于含铂化疗达到完全或部分缓解的复发性卵巢癌全人群维持治疗。同样ARIEL3研究结果显示,在ITT人群、HRD+和BRCAm患者中,卢卡帕利治疗组主要终点PFS显著优于对照组11,因此ESMO指南同样推荐卢卡帕利维持治疗不限BRCA突变状态。
目前所有PARP抑制剂临床研究均以PFS为主要研究终点,由于患者的后续治疗方法混杂和数据删失情况,NOVA及ARIEL3研究设计不足以分析OS,但在美国真实世界研究中已发现尼拉帕利用于BRCAwt复发卵巢癌维持治疗较主动监测可延长患者OS达5.7~6.6个月12-13。
2.2 推荐奥拉帕利用于BRCAm患者维持治疗
ESMO指南推荐奥拉帕利用于BRCAm患者的维持治疗是基于对Study 19和SOLO2两项研究的分析。Study 19为一项II期临床研究,旨在观察奥拉帕利维持治疗铂敏感复发卵巢癌的疗效,虽然结果显示BRCAm及BRCAwt患者使用奥拉帕利维持治疗均可改善PFS,但BRCA突变状态未在预设分层因素中14,因此证据级别较低,并且在BRCAwt患者中,奥拉帕利治疗组中位OS为24.5个月,对照组为26.6个月(HR 0.84, 95% CI 0.57-1.25, p=0.397)15。另一项III期临床研究SOLO2循证级别虽高于Study 19,但该研究仅纳入了gBRCAm的铂敏感复发卵巢癌患者16。OPINION研究和L-MOCA研究由于是单臂试验17-18,缺少对照组的情况下,在结果解读、证据应用等方面有较大局限性和不确定性。基于以上循证医学证据,ESMO指南对奥拉帕利维持治疗人群给出了与NCCN指南不同的推荐19。
二、Clinical in China, Evidence for World
作为首个PARP抑制剂用于中国铂敏感复发卵巢癌患者维持治疗的大型III期随机对照临床研究,早在入选ESMO指南前,NORA研究已多次亮相国际学术舞台,受到国外同行的高度关注和认可。
个体化起始剂量,助推精准化治疗
NOVA研究事后分析发现,基线体重<77 kg或基线血小板计数<150000/μL的患者接受200 mg/天的起始剂量可能获益更优,这为优化尼拉帕利给药策略提供了方向20。因此NORA研究前瞻性的采用了个体化起始剂量(体重≥77 kg且血小板≥150000/μL 300 mg/d起始,体重<77 kg或血小板<150000/μL 200 mg/d起始)。尼拉帕利个体化起始剂量使患者耐受性更好,相较NOVA研究14.7%的治疗终止率,NORA研究仅为4%21。
不论gBRCA突变状态如何,尼拉帕利均有显著PFS获益
NORA研究结果显示,在ITT人群中,尼拉帕利组和安慰剂组患者的中位PFS分别为18.3个月和5.4个月(HR 0.32,95% CI 0.23-0.45,p<0.0001)。亚组分析显示,在尼拉帕利组和安慰剂组中,gBRCAm患者的中位PFS分别为NR和5.5个月(HR 0.22,95% CI 0.12-0.39,p<0.0001);非gBRCAm患者中位PFS分别为11.1个月和3.9个月(HR 0.40,95% CI 0.26-0.61,p<0.0001)21。从HR值来看,NORA研究个体化起始剂量相比NOVA研究的固定起始剂量有更好的PFS获益趋势。
全人群OS获益趋势
截至2022年9月23日,中期OS分析时数据成熟度为44%。在安慰剂组43%的患者(gBRCAm患者占比54%,非gBRCAm患者占比36%)接受了后续PARP抑制剂治疗的情况下,尼拉帕利依然显示出全人群OS获益趋势22。ITT人群中,尼拉帕利组中位OS为46.3个月,长于安慰剂组的43.4个月,HR值为0.821。gBRCAm患者中,尼拉帕利组中位OS未达到,安慰剂组中位OS为47.6个月,HR值为0.764。非gBRCAm患者中,尼拉帕利组中位OS为43.1个月,长于安慰剂组的38.4个月,HR值为0.855。在铂敏感复发维持治疗阶段,此前多项研究均显示PARP抑制剂和抗血管生成药物用于非gBRCAm患者难以取得OS获益,而NORA研究首次显示出OS获益趋势,具有里程碑式的意义,对于EMA和亚洲其他地区评估尼拉帕利用于铂敏感复发卵巢癌全人群维持治疗的适应证起到了关键性作用。
总结
作为全球最具权威性的学术指南之一,ESMO指南的制定充分考虑了临床研究结果、药物可及性、患者特征等情况,对指导临床实践发挥了重要作用,值得国内同行借鉴,在临床工作中,应汲取指南中的精华,取长补短,并优先参考基于中国人群的研究数据,力争为每位卵巢癌患者提供符合指南推荐原则的个体化精准治疗。
以往国内缺乏高质量、系统性的临床研究以及具有全球影响力的研究成果,能够真正改写国际指南并优化临床实践的研究更是少之又少。新版ESMO指南对于尼拉帕利全人群维持治疗推荐时参考了NORA研究结果,代表国内妇瘤领域科研水平得到国外同行的高度认可,期待未来国内有更多高质量的临床研究不断涌现,为全球卵巢癌临床实践贡献中国力量。
专家简介

吴小华 教授
复旦大学附属肿瘤医院主任医师、博士生导师
复旦大学附属肿瘤医院妇瘤科主任、妇科肿瘤多学科综合治疗团队首席专家
中国抗癌协会卵巢癌专委会主任委员
中国初级卫生保健基金会妇科专委会主任委员
上海市抗癌协会妇科肿瘤专委会前任主委
中国抗癌协会常务理事
上海市抗癌协会常务理事
中国临床肿瘤学会 (CSCO) 理事
IGCS 国际委员会委员、亚太理事提名人
SGO 教育委员会委员、执行委员
NCCN 国际审阅专家;Int. J. Gynecol Cancer, Cancer Medicine,
J. Gynecol Cancer, 中华妇产科学,中华临床解剖学等杂志编委
参考文献
1. Ledermann JA, et al. Ann Oncol. 2013 Oct;24 Suppl 6:vi24-32.
2. Colombo N, et al. Ann Oncol. 2021 Oct;32(10):1300-1303.
3. González-Martín A, et al. Ann Oncol. 2023 Aug 17:S0923-7534(23)00797-4.
4. Wang Y, et al. Cancer Res. 2022 Nov 2;82(21):3903-3916.
5. Friedlander M, et al. Int J Gynecol Cancer. 2011 May;21(4):771-5.
6. Pujade-Lauraine E, et al. J Clin Oncol. 2019 Sep 20;37(27):2437-2448.
7. Baert T, et al. Ann Oncol. 2021 Jun;32(6):710-725.
8. Mirza MR, et al. N Engl J Med. 2016 Dec 1;375(22):2154-2164.
9. Matulonis UA, et al. Society of Gynecologic Oncology 2023 Annual Meeting on Women’s Cancer. Presented March 25, 2023.
10. M.R. Mirza, et al. Annals of Oncology, Volume 34, Issue 1, 2023.
11. Coleman RL, et al. Lancet. 2017 Oct 28;390(10106):1949-1961.
12. Robert L. et al. Journal of Clinical Oncology 2023 41:16_suppl, 5592-5592.
13. K.N. Moore, et al. Annals of Oncology (2023) 8 (1suppl_1): 100811-100811.
14. Ledermann J, et al. N Engl J Med. 2012 Apr 12;366(15):1382-92.
15. Friedlander M, et al. Br J Cancer. 2018 Oct;119(9):1075-1085.
16. Poveda A, et al. Lancet Oncol. 2021 May;22(5):620-631.
17. Poveda A, et al. Gynecol Oncol. 2022 Mar;164(3):498-504.
18. Gao Q, et al. Clin Cancer Res. 2022 Jun 1;28(11):2278-2285.
19. NCCN Guidelines Version 2.2023 Ovarian Cancer.
20. Berek JS, et al. Ann Oncol. 2018 Aug 1;29(8):1784-1792.
21. Wu XH, et al. Ann Oncol. 2021 Apr;32(4):512-521.
22. X. Wu, et al. ESMO Open, Volume 8, Issue 1, Supplement 1, 2023.
声明:本文仅供医疗卫生专业人士为了解资讯使用,不代表本平台观点。该等信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解资讯以外的目的,平台及作者不承担相关责任。
