卵巢癌是病死率最高的妇科恶性肿瘤,70%的卵巢癌患者就诊时已届临床晚期。新诊断卵巢癌初始治疗模式为肿瘤细胞减灭术和以铂类药物为基础的联合化疗。虽然大多数患者经过初始治疗可获得临床缓解,但仍有70%的患者在2~3年内复发,5年生存率一直徘徊在40%左右。近年来,多腺苷二磷酸核糖聚合酶(poly ADP ribose polymerase,PARP)抑制剂的问世为卵巢癌的治疗带来了重大变革,系列高级别循证医学证据表明在初始治疗或铂敏感复发治疗获得完全缓解(complete response,CR)和部分缓解(partial response,PR)后应用PARP抑制剂可显著延长卵巢癌患者的无进展生存(progression-free survival,PFS)时间,PARP抑制剂维持治疗改变了卵巢癌的治疗模式。近年来PARP抑制剂已广泛应用于临床,为规范此类药物的临床应用,2020年中华医学会妇科肿瘤学分会制定了《卵巢癌PARP抑制剂临床应用指南》(以下简称“原指南”),随着临床研究数据的更新和临床实践经验的积累,有必要对原指南进行修订,经中华医学会妇科肿瘤学分会编写组专家和常务委员充分讨论和投票表决,形成《卵巢癌PARP抑制剂临床应用指南(2022版)》(以下简称“本指南”)。
本指南采用中华医学会妇科肿瘤学分会推荐级别,见表1。

本指南中,卵巢癌包括输卵管癌和原发性腹膜癌。本指南不涉及国内未上市的PARP抑制剂。本指南临床研究中乳腺癌易感基因(breast cancer susceptibility gene,BRCA)突变为致病性或可能致病性突变。
1?PARP抑制剂及其作用机制
1963年Chambon等[1]首先发现了PARP,后经证实其参与单链DNA损伤后的修复过程。1980年Durkacz等[2]证明烟酰胺类似物可以抑制DNA修复,并可增强DNA损伤剂硫酸二甲酯的细胞毒性,提示其有可能作为增敏剂与细胞毒性药物联合用于肿瘤治疗。2005年Nature同期发表的2项研究首次证实了PARP抑制剂与BRCA1/2突变之间存在“合成致死”效应[3,4]。目前已知PARP家族包括17个成员,其中PARP1和PARP2主要通过碱基切除修复(base excision repair,BER)途径在DNA单链断裂(single strand break,SSB)修复中发挥重要作用。
PARP抑制剂经历了3次更新换代,第3代PARP抑制剂以复合物单晶结构为基础,具有活性高、选择性好等优点。多项研究表明晚期卵巢上皮性癌患者应用PARP抑制剂进行维持治疗获益显著。
1.1
作用机制
BRCA1/2基因是抑癌基因,在DNA损伤修复、细胞正常生长等方面均具有重要作用。该基因突变可抑制DNA损伤后正常修复能力,引起同源重组缺陷(homologous recombination deficiency,HRD),即BRCA功能缺失或其他同源重组相关基因发生突变或功能缺失,使双链断裂的DNA修复不能通过同源重组修复(homologous recombinant repair,HRR),最终导致癌变。PARP在DNA单链碱基切除、修复过程中发挥关键作用。在HRD肿瘤细胞中DNA双链无法修复,PARP抑制剂又阻断单链修复,从而形成“合成致死”效应,导致肿瘤细胞死亡。
PARP抑制剂对PARP的作用机制包括2个方面:①在PARP活性位点与烟酰胺腺嘌呤二核苷酸竞争,抑制多聚(ADP-核糖)聚合物形成;②结合到PARP1和/或PARP2的烟酰胺腺嘌呤二核苷酸结合口袋,造成构象异构,稳定DNA-PARP的可逆解离,使PARP保持对DNA的结合,这一过程被称为DNA-PARP复合物的“捕获(trapping)”,从而导致DNA-PARP复合物长期存在,抑制DNA后续修复过程[5]。越来越多的临床研究表明,PARP抑制剂的作用不仅限于BRCA突变或HRD阳性的卵巢癌患者,铂敏感的卵巢癌患者也可从中获益,其机制可能与PARP抑制剂的捕获作用有关。
1.2
药理学特性
不同PARP抑制剂的药理学特性有所不同,已获美国食品药品监督管理局(Food and Drug Administration,FDA)、中国国家药品监督管理局(National Medical Products Administration,NMPA)批准的几种PARP抑制剂在生物利用度、半衰期、代谢酶和组织分布等方面各有优势。
1.2.1?奥拉帕利(olaparib)?包括片剂和胶囊2种剂型(胶囊剂型未在中国申请上市),片剂口服给药后1.5 h达到中位血浆峰浓度。其体外蛋白结合率约为82%,表观分布容积(apparent volume of dis­tri­bution,Vd)为(158±136)L,在体内主要通过CYP3A4/5酶代谢;300 mg单次给药后,半衰期为(14.9±8.2)h。
1.2.2?尼拉帕利(niraparib)?胶囊剂型。绝对生物利用度约为73%,口服给药后3 h内达血浆峰浓度。其与人血浆蛋白的结合率为83.0%,Vd为(1220±1114)L,主要通过羧酸酯酶代谢,形成无活性代谢产物,随后发生葡糖苷酸化,平均半衰期为36 h。
1.2.3?氟唑帕利(fluzoparib)?胶囊剂型。单次口服150 mg给药后2.5 h达血浆峰浓度,人血浆蛋白结合率为74.3%~81.6%,稳态表观分布容积为(34.6±14.5)L,主要通过CYP3A4酶代谢,150 mg氟唑帕利多次给药后平均末端消除半衰期约为(9.14±2.38)h。
1.2.4?帕米帕利(pamiparib)?胶囊剂型。在给药后1~2 h达到血浆峰浓度,稳态时观察到在有限的中国患者中40 mg的暴露量与60 mg接近,人血浆蛋白结合率为95.7%,60 mg每日2次给药,帕米帕利的Vd约为37 L,主要由CYP2C8和CYP3A酶代谢,血浆中消除半衰期约为13 h。本品在临床剂量下不大可能是肠道外排转运蛋白P-糖蛋白(P-glycoprotein,P-gp)和乳腺癌抗性蛋白(breast cancer resistance protein,BCRP)、肝摄取转运蛋白有机阴离子转运多肽(organic anion transporting polypeptide,OATP)1Bl/1B3、肾摄取转运蛋白有机阳离子转运蛋白(organic cation transporter,OCT)2和有机阴离子转运蛋白(organic anion transp­orter,OAT)1、OAT3的抑制剂。
1.3
获批情况
目前美国FDA批准3种PARP抑制剂、中国NMPA批准4种PARP抑制剂应用于临床,其适应证见表2。

1.4
应用PARP抑制剂的生物标志物
BRCA基因突变或HRD是目前常用的PARP抑制剂应用生物标志物。
1.4.1?BRCA基因检测?BRCA基因突变是首选的PARP抑制剂敏感生物标志物[18]。BRCA基因突变包括胚系BRCA(germ line BRCA,gBRCA)突变和体细胞BRCA(somatic BRCA,sBRCA)突变,从肿瘤组织检测的BRCA突变用组织细胞BRCA(tissue BRCA,tBRCA)突变描述。国内外多采用二代测序(next-generation sequencing,NGS)检测,突变类型包括点突变、小片段插入/缺失等。BRCA基因检测报告解读(胚系变异)依据国际癌症研究机构(International Agency for Research on Cancer,IARC)分类标准(表3)。

本指南推荐卵巢癌患者在初次病理确诊时即进行BRCA基因检测。
1.4.2?HRD检测?除BRCA1/2基因突变外,其他HRR基因,如RAD51、ATM、PALB2、MRE11等损伤或缺失也会导致HRD,HRD作为PARP抑制剂敏感的生物标志物已应用于临床[19]。HRD检测可以使PARP抑制剂敏感人群从约占25%的BRCA突变人群扩大到约占50%的HRD阳性人群。HRD可通过同源重组相关基因突变检测和基因瘢痕检测两种方式判断。前者是从基因水平利用NGS平台对同源重组相关基因进行检测。该方法存在一定的缺陷:①除BRCA基因外,其他基因的检出率均较低;②不同的HRR基因通道纳入基因存在差异,缺乏公认的标准;③不论是HRR基因通道还是HRD基因瘢痕检测均无法检出同源重组通路基因表观遗传改变(如BRCA1启动子区甲基化),因此存在一定的假阴性比例;④不同基因对同源重组通路功能影响不同,缺乏量化指标;⑤经济成本效益也需要考虑并知情告知。目前PARP抑制剂临床试验中的HRD检测方法多采用后者,它不仅可以检测BRCA状态,还可以分析基因不稳定状态类型。
目前国际上HRD检测有2个比较成熟的技术平台:Myriad myChoice? CDx(Myriad Genetic Laboratories, Inc.)和FoundationFocusTM CDx BRCA LOH(Foundation Medicine, Inc.)。
FoundationFocusTM CDx BRCA LOH检测包括2个主要因素:肿瘤BRCA突变状态和基因组杂合性缺失(loss of heterozygosity,LOH)。tBRCA突变,无论LOH比率多少均为HRD阳性;tBRCA无突变,高LOH(LOH比率≥16%)的患者也归为HRD阳性;BRCA为野生型且LOH比率<16%则定义为HRD阴性。
Myriad myChoice? CDx检测主要针对基因组不稳定状态的3项指标在肿瘤样本中出现的数量进行综合评分,即LOH、端粒等位基因不平衡(telomeric allelic imbalance,TAI)、大片段迁移(large-scale transition,LST)。若分值≥42分或BRCA1/2突变,则定义为HRD阳性;若分值<42分,且BRCA为野生型,则定义为HRD阴性。
Myriad myChoice? CDx和FoundationFocusTM CDx BRCA LOH缺乏应用于中国人群的大样本前瞻性临床研究的验证,HRD检测的设计应结合我国人群的分子遗传学特征。目前国内HRD检测产品尚未获批,但已有相关研究探索基于中国人群的遗传多态性数据开发HRD算法[20,21],相关检测平台已应用于一些临床研究。
2卵巢癌的一线维持治疗
卵巢癌一线维持治疗是对新诊断卵巢癌患者完成初始化疗后达到临床CR或PR者所给予的后续巩固治疗,旨在推迟复发,改善生存预后。应用化疗药物进行维持治疗的临床疗效难以肯定,目前不再推荐临床应用。应用抗血管生成药物贝伐珠单抗维持治疗前需与初始化疗联合应用,除高复发风险患者外,一般人群的PFS时间延长不够理想,仅3~4个月。近年来,PARP抑制剂作为一线维持治疗药物完成了多项Ⅲ期临床随机对照试验,疗效显著,已成为部分卵巢癌患者一线维持治疗的最佳选择。
2.1
奥拉帕利相关研究
2.1.1?SOLO-1研究[10]?针对BRCA1/2基因突变的晚期上皮性卵巢癌(epithelial ovarian cancer,EOC)患者,在初始治疗有效后应用奥拉帕利对比安慰剂进行Ⅲ期临床随机对照试验。全球数据中位随访时间为41个月,与安慰剂组相比,奥拉帕利组患者复发或死亡风险下降70%,两组患者的3年PFS率分别为60%和27%[风险比(hazard ratio,HR)=0.30,95%CI:0.23~0.41,P<0.001],中位复发时间推迟到3年以上。无论手术时机如何、化疗反应状态和残留病灶大小[22],接受奥拉帕利维持治疗的晚期卵巢癌患者PFS均明显改善。更新的随访5年数据[23]显示,奥拉帕利组和安慰剂组患者的中位PFS时间分别为56.0个月和13.8个月,复发或死亡风险降低67%(HR=0.33,95%CI:0.25~0.43);且PFS获益在高风险和低风险亚组中一致。中国队列的疗效(独立盲法评估的HR=0.39,95%CI:0.17~0.86,P=0.0168)和安全性数据与全球数据基本一致[24]。
2.1.2?PAOLA-1研究[14]?这是一项Ⅲ期临床随机对照试验,针对一线含铂类药物联合贝伐珠单抗治疗有效的晚期EOC患者,在继续应用贝伐珠单抗维持治疗的同时加用或不加用奥拉帕利。在贝伐珠单抗联合奥拉帕利组和贝伐珠单抗联合安慰剂组中,BRCA突变患者的中位PFS时间分别为37.2个月和21.7个月(HR=0.31,95%CI:0.20~0.47);BRCA野生型/HRD阳性患者中位PFS时间分别为28.1个月和16.6个月(HR=0.43,95%CI:0.28~0.66);BRCA野生型/HRD阴性/未知患者中位PFS时间分别为16.9个月和16.0个月(HR=0.92,95%CI:0.72~1.17),但差异无统计学意义。研究表明,在贝伐珠单抗维持治疗的基础上加用奥拉帕利可使BRCA突变和BRCA野生型/HRD阳性患者获益,但对BRCA野生型/HRD阴性(双阴性)患者没有额外获益。无论手术时机或术后残留病灶状况[25]如何,与贝伐珠单抗相比,奥拉帕利联合贝伐珠单抗维持治疗均改善PFS,初始肿瘤细胞减灭术且术后肉眼无残留病灶者获益最显著。在HRD阳性患者中,无论国际妇产科联盟(International Fede­r­ation of Gynecology and Obstetrics,FIGO)分期和年龄大小[26,27],在贝伐珠单抗基础上联合奥拉帕利患者PFS均明显改善。
2.2
尼拉帕利相关研究
2.2.1?PRIMA研究[13]?针对初次减瘤术未达到R0切除的晚期EOC患者,在初始治疗后应用尼拉帕利或安慰剂进行随机对照试验。无论是否存在BRCA突变均可纳入研究,随机分组时将HRD状态作为分层因素。研究显示BRCA突变者获益最大,尼拉帕利组和安慰剂组患者中位PFS时间分别为22.1个月和10.9个月(HR=0.40,95%CI:0.27~0.62,P<0.001)。亚组分析显示,在尼拉帕利组和安慰剂组中,BRCA野生型/HRD阳性患者中位PFS时间分别为19.6个月和8.2个月(HR=0.50,95%CI:0.31~0.83,P=0.006);BRCA野生型/HRD阴性患者的中位PFS时间分别为8.1个月和5.4个月(HR=0.68,95%CI:0.49~0.94,P=0.020),其获益程度明显小于BRCA突变患者和HRD阳性患者。在PRIMA研究中,不论为何年龄组[28]、手术时机和残留病灶[29],接受尼拉帕利维持治疗的晚期卵巢癌患者均改善PFS,接受中间型肿瘤细胞减灭术(interval debulking surgery,IDS)且残留肉眼可见病灶者PFS获益最显著。
2.2.2?PRIME研究[30]?是尼拉帕利在中国新诊断晚期卵巢癌患者中开展的多中心、随机、安慰剂对照Ⅲ期临床研究。与PRIMA研究的不同点是该研究无论术后残余病灶状态如何均可入组,且全人群采用尼拉帕利个体化起始剂量给药。在尼拉帕利组和安慰剂组中,整体人群的中位PFS时间分别为24.8个月和8.3个月(HR=0.45,95%CI:0.34~0.60,P<0.001);gBRCA突变患者的中位PFS时间分别为未达到(not reached,NR)和10.8个月(HR=0.40,95%CI:0.23~0.68,P<0.001);非gBRCA突变/HRD阳性患者的中位PFS时间分别为24.8个月和11.1个月(HR=0.58,95%CI:0.36~0.93,P=0.022);HRD阴性患者的中位PFS时间分别为14.0个月和5.5个月(HR=0.41,95%CI:0.25~0.65,P<0.001)。无论患者一线含铂化疗后是否达到CR或PR,与安慰剂相比,尼拉帕利均显著延长PFS时间[31]。两项研究均表明PARP抑制剂用于一线维持治疗可使晚期EOC患者全人群有不同程度的显著获益。
2.2.3?OVARIO研究[32,33]?是一项评估尼拉帕利联合贝伐珠单抗用于新诊断晚期卵巢癌患者维持治疗的Ⅱ期单臂临床研究,主要研究终点为18个月PFS率。研究显示整体人群18个月、24个月的PFS率分别为62%和53%,HRD阳性人群分别为76%和63%,HRD阴性人群分别为47%和42%,HRD未知人群分别为56%和50%。中位随访时间28.7个月,整体人群中位PFS时间为19.6个月,BRCA突变、BRCA野生型/HRD阳性、HRD阴性、HRD未知人群分别为NR、28.3个月、14.2个月和12.1个月。该研究初步表明尼拉帕利联合贝伐珠单抗应用于一线维持治疗可以获益。
基于上述研究证据,推荐相应PARP抑制剂用于一线维持治疗(表4)。
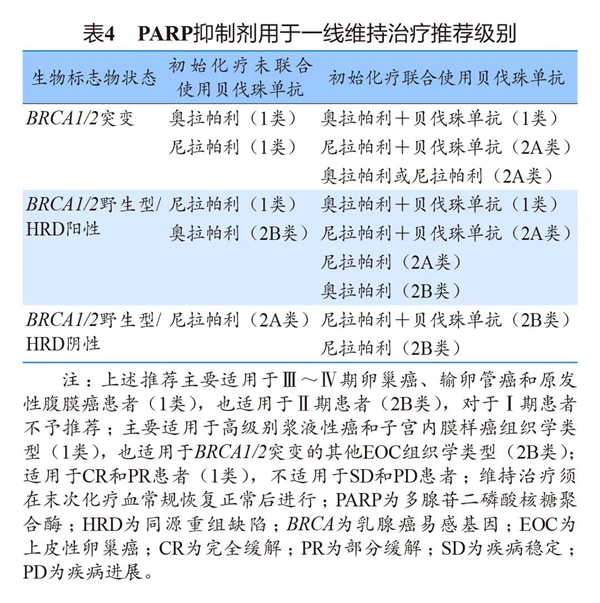
3、复发性卵巢癌的维持治疗
卵巢癌复发分为铂敏感复发和铂耐药复发,前者指化疗结束后6个月及以上的复发,后者指化疗结束后不足6个月的复发。初始治疗后未控制,呈持续性甚至进展性疾病者,也属于铂耐药范畴。铂敏感复发的治疗原则是继续使用以铂类为基础的联合化疗,耐药者则选用非铂类化疗药物治疗。复发患者经治疗缓解后可考虑维持治疗,以推迟复发时间或降低复发风险。长期以来,用于复发性卵巢癌维持治疗的药物不多,贝伐珠单抗维持治疗的疗效持续时间较短。近年来,PARP抑制剂用于铂敏感复发维持治疗的研究取得较大突破,已被公认为铂敏感复发后维持治疗的标准治疗。
3.1
奥拉帕利相关研究
3.1.1?Study 19研究[8]?针对铂敏感复发患者,Ⅱ期研究显示,奥拉帕利维持治疗组和安慰剂组患者的中位PFS时间分别为8.4个月和4.8个月(HR=0.35,95%CI:0.25~0.49,P<0.001)。亚组分析显示BRCA突变患者中位PFS时间分别为11.2个月和4.3个月(HR=0.18,95%CI:0.10~0.31,P<0.0001);BRCA野生型患者中位PFS时间分别为7.4个月和5.5个月(HR=0.54,95%CI:0.34~0.85,P=0.0075)。总生存(overall survival,OS)分析显示[34],奥拉帕利组和安慰剂组患者中位OS时间分别为29.8个月和27.8个月[HR=0.73,95%CI:0.55~0.95,P=0.021 38(未达预设的统计学差异阈值)];探索性限制性分析显示奥拉帕利组和安慰剂组患者的中位OS时间分别为41.6个月和35.3个月。BRCA突变患者中位OS时间分别为34.9个月和30.2个月(HR=0.62,95%CI:0.42~0.93,P=0.021 40),BRCA野生型患者中位OS时间分别为24.5个月和26.6个月(HR=0.84,95%CI:0.57~1.25,P=0.397 49)。该研究初步表明奥拉帕利可使铂敏感复发患者获益。
3.1.2?SOLO-2研究[9]?该研究是针对gBRCA突变的铂敏感复发患者的Ⅲ期临床研究,结果显示,奥拉帕利组和安慰剂组患者中位PFS时间分别为19.1个月和5.5个月(HR=0.30,95%CI:0.22~0.41,P<0.0001);独立盲法评估的中位PFS时间分别为30.2个月和5.5个月(HR=0.25,95%CI:0.18~0.35,P<0.0001)。OS分析显示[35],奥拉帕利组和安慰剂组患者的中位OS时间分别为51.7个月和38.8个月(HR=0.74,95%CI:0.54~1.00,P=0.054),安慰剂组中38%的患者后续接受PARP抑制剂治疗,校正安慰剂组交叉用药后,奥拉帕利组和安慰剂组患者的中位OS分别为51.7个月和35.4个月(HR=0.56,95%CI:0.35~0.97)。本研究首次证实奥拉帕利维持治疗可以使gBRCA突变患者OS显著获益。
3.1.3?OPINION研究[36]?该研究是针对非gBRCA突变的铂敏感复发患者的Ⅲb期研究,主要分析显示,奥拉帕利维持治疗整体人群的中位PFS时间为9.2个月。亚组分析显示,sBRCA突变患者中位PFS时间为16.4个月,HRD阳性(包括sBRCA突变)患者中位PFS时间为11.1个月,HRD阳性(除外sBRCA突变)患者中位PFS时间为9.7个月,HRD阴性患者中位PFS时间为7.3个月。该研究补充证实了奥拉帕利对非gBRCA突变铂敏感复发患者维持治疗的有效性。
3.1.4?L-MOCA研究[37]?该研究是针对亚洲铂敏感复发卵巢癌患者的Ⅲ期单臂研究,其中91.5%为中国患者,研究结果显示奥拉帕利维持治疗整体人群的中位PFS时间为16.1个月,预估的6个月和12个月PFS率分别为76.0%和57.1%。其中,BRCA突变患者中位PFS时间为21.2个月,gBRCA突变患者中位PFS时间为21.4个月,BRCA野生型患者中位PFS时间为11.0个月。亚组分析显示既往接受二线治疗的患者中位PFS时间可达到18.0个月,其中二线BRCA突变患者中位PFS时间可达24.9个月,二线BRCA野生型患者中位PFS时间可达14.1个月,与全人群的亚组分析结果趋势一致。研究表明,无论BRCA突变状态如何,奥拉帕利维持治疗均可使亚洲铂敏感复发患者显著获益。
3.2
尼拉帕利相关研究
3.2.1?NOVA研究[7]?该研究针对铂敏感复发患者,在尼拉帕利组和安慰剂组中,gBRCA突变患者中位PFS时间分别为21.0个月和5.5个月(HR=0.27,95%CI:0.17~0.41,P<0.001);gBRCA野生型/HRD阳性患者中位PFS时间分别为12.9个月和3.8个月(HR=0.38,95%CI:0.24~0.59,P<0.001);BRCA野生型/HRD阳性患者中位PFS时间分别为9.3个月和3.7个月(HR=0.38,95%CI:0.23~0.63,P<0.001);BRCA野生型/HRD阴性患者中位PFS时间分别为6.9个月和3.8个月(HR=0.58,95%CI:0.36~0.92,P=0.02)。研究表明尼拉帕利维持治疗为不同BRCA和HRD状态的铂敏感复发患者带来不同程度的生存获益。在NOVA研究中,不论为何年龄组[38]和化疗反应状态[39],在gBRCA突变和非gBRCA突变者中,接受尼拉帕利维持治疗的铂敏感复发患者PFS均改善。OS分析显示[40],在尼拉帕利组和安慰剂组中,gBRCA突变患者的中位OS时间分别为43.6个月和41.6个月(HR=0.93,95%CI:0.633~1.355),非gBRCA突变患者的中位OS时间分别为31.1个月和36.5个月(HR=1.10,95%CI:0.831~1.459)。在整体人群中,25%的患者进展后治疗相关信息缺失,采用逆概率删失加权法(inverse probability of censoring weighting,IPCW)调整后续PARP抑制剂的应用。应用IPCW后,在尼拉帕利组和安慰剂组中,gBRCA突变患者的中位OS时间分别为43.8个月和34.1个月(HR=0.66,95%CI:0.44~0.99),非gBRCA突变患者的中位OS时间分别为31.3个月和35.9个月(HR=0.97,95%CI:0.74~1.26)。
3.2.2?NORA研究[12]?该研究是对中国铂敏感复发卵巢癌患者开展的采用尼拉帕利个体化起始剂量的Ⅲ期随机对照研究。在整体人群中,尼拉帕利组和安慰剂组患者的中位PFS时间分别为18.3个月和5.4个月(HR=0.32,95%CI:0.23~0.45,P<0.0001)。亚组分析提示,在尼拉帕利组和安慰剂组中,gBRCA突变患者的中位PFS时间分别为NR和5.5个月(HR=0.22,95%CI:0.12~0.39,P<0.0001);非gBRCA突变患者中位PFS时间分别为11.1个月和3.9个月(HR=0.40,95%CI:0.26~0.61,P<0.0001)。该研究表明采用尼拉帕利个体化起始剂量可为不同BRCA状态的中国铂敏感复发患者带来生存获益。在NORA研究中,不论为何化疗反应状态[41]、前次含铂化疗后6~12个月或≥12个月疾病进展[42],在gBRCA突变和非gBRCA突变者中,接受尼拉帕利维持治疗的铂敏感复发患者均能改善PFS。另外,无论是否接受二次肿瘤细胞减灭术[43],尼拉帕利维持治疗均可改善患者PFS。
3.3
氟唑帕利相关研究
FOZCUS-2研究[17]是针对铂敏感复发卵巢癌患者维持治疗的Ⅲ期临床研究。结果显示,氟唑帕利组和安慰剂组患者的中位PFS时间分别为12.9个月(中位PFS时间尚未成熟,12.9个月为根据K-M曲线预测值)和5.5个月(HR=0.25,95%CI:0.17~0.36,P<0.0001),亚组分析显示,gBRCA突变人群复发或死亡风险降低86%(HR=0.14,95%CI:0.07~0.28),非gBRCA突变人群复发或死亡风险降低54%(HR=0.46,95%CI:0.29~0.74)。该研究表明氟唑帕利可为不同BRCA状态的中国铂敏感复发患者维持治疗后带来PFS获益。
3.4
PARP抑制剂维持治疗后的再次维持治疗
OReO研究[44]是针对既往接受过多线治疗和一次PARP抑制剂维持治疗且末次含铂化疗达到CR/PR的复发性卵巢癌患者,再次应用奥拉帕利维持治疗的Ⅲb期随机对照研究。结果显示,奥拉帕利再次维持治疗对比安慰剂组,BRCA突变患者中位PFS时间分别为4.3个月和2.8个月(HR=0.57,95%CI:0.37~0.87,P=0.022);非BRCA突变患者中位PFS时间分别为5.3个月和2.8个月(HR=0.43,95%CI:0.26~0.71,P=0.0023),其中BRCA野生型/HRD阳性患者中位PFS时间分别为5.3个月和2.8个月(HR=0.52,95%CI:0.26~1.10);BRCA野生型/HRD阴性患者中位PFS时间分别为5.4个月和2.8个月(HR=0.49,95%CI:0.21~1.23)。研究表明奥拉帕利再次维持治疗对不同BRCA和HRD状态的患者可有一定程度的PFS获益。值得注意的是,与BRCA突变组相比,非BRCA突变组再次奥拉帕利维持治疗的PFS获益较大,分析发现非BRCA突变组中PARP抑制剂先后使用不同种类的比例高于BRCA突变组。
基于以上临床研究证据,对于含铂化疗达到CR或PR的铂敏感复发全人群患者,推荐奥拉帕利、尼拉帕利和氟唑帕利维持治疗,基于获益程度,对BRCA突变患者为1类推荐,对BRCA野生型/HRD阳性患者和BRCA野生型/HRD阴性患者为2A类推荐。对既往应用PARP抑制剂维持治疗6个月以上者,推荐可以再次应用奥拉帕利维持治疗(2B类推荐),先后应用不同的PARP抑制剂是否更加获益值得进一步临床研究验证。
4?复发性卵巢癌的后线治疗
对既往接受大于二线化疗的复发性卵巢癌患者的治疗为后线治疗。后线治疗患者的一般状况较差,对药物反应不敏感,可供临床选择的有效药物比较缺乏,而PARP抑制剂相对于细胞毒性化疗药物毒性较小,用于后线治疗具有一定的优势。多种PARP抑制剂相继获得美国FDA或中国NMPA批准用于多次复发的卵巢癌的后线治疗,为此类患者提供了“去化疗”的治疗选择。
4.1
铂敏感复发卵巢癌的治疗
对铂敏感复发卵巢癌患者应该首选含铂化疗方案,但对于难以耐受含铂化疗、对铂类药物过敏、不再同意接受化疗者,有必要探索其他替代治疗方案。
4.1.1 奥拉帕利相关研究
4.1.1.1?SOLO-3研究[45,46]?
该研究是应用奥拉帕利单药治疗既往接受了二线及以上化疗的gBRCA突变铂敏感复发卵巢癌患者的Ⅲ期随机对照研究,结果显示,与由医生自主决定的不含铂类的化疗方案相比,奥拉帕利单药治疗显著提高了患者的客观缓解率(objective response rate,ORR)[72.2%∶51.4%,比值比(odds ratio,OR)=2.53,95%CI:1.40~4.58,P=0.002],奥拉帕利组和化疗组的独立盲法评估的中位PFS时间分别为13.4个月和9.2个月(HR=0.62,95%CI:0.43~0.91,P=0.013)。最终生存分析显示,奥拉帕利组和化疗组患者的中位OS时间分别为34.9个月和32.9个月,两组比较差异无统计学意义(HR=1.07,95%CI:0.76~1.49,P=0.714),可能与25%的化疗组患者提前退出研究影响评估OS相关。
4.1.1.2?CLIO研究[47]?
在BRCA野生型铂敏感复发的EOC患者中,与标准治疗(卡铂联合多柔比星脂质体/吉西他滨)相比,奥拉帕利单药治疗的ORR、疾病控制率、中位PFS时间、中位OS时间比较差异均无统计学意义。
4.1.1.3?LIGHT研究[48,49]?
是基于BRCA突变和HRD状态评估铂敏感复发EOC患者接受奥拉帕利治疗的研究。结果显示,gBRCA突变、sBRCA突变、BRCA野生型/HRD阳性、BRCA野生型/HRD阴性患者的ORR分别为69%、64%、29%、10%;中位PFS时间分别为11.0个月、10.8个月、7.2个月、5.4个月;18个月的OS率分别为88.0%、86.4%、78.6%、59.6%。
4.1.2 尼拉帕利相关研究
4.1.2.1 QUADRA研究[11]?
在尼拉帕利单药治疗既往接受过三线及以上治疗的铂敏感复发卵巢癌患者中,BRCA突变患者的ORR为39%,HRD阳性患者的ORR为26%。
4.1.2.2 AVANOVA2研究[50,51]
该研究是一项比较尼拉帕利联合贝伐珠单抗或尼拉帕利单药治疗不限既往治疗线数的铂敏感复发EOC患者的Ⅱ期随机对照研究。结果显示,中位随访时间16.9个月,在尼拉帕利联合贝伐珠单抗治疗组和尼拉帕利单药治疗组中,患者的中位PFS时间分别为11.9个月和5.5个月(HR=0.35,95%CI:0.21~0.57,P<0.0001),ORR分别为60%和27%(OR=4.23,P=0.001)。其中,BRCA突变患者中位PFS时间分别为14.4个月和9.0个月(HR=0.49,95%CI:0.21~1.15);BRCA野生型/HRD阳性患者中位PFS时间分别为11.9个月和4.1个月(HR=0.19,95%CI:0.06~0.59);BRCA野生型/HRD阴性患者中位PFS时间分别为11.3个月和4.2个月(HR=0.40,95%CI:0.19~0.85)。生存分析显示,尼拉帕利联合贝伐珠单抗治疗组和尼拉帕利单药治疗组患者的中位OS时间分别为29.4个月和27.8个月(HR=0.75,95%CI:0.44~1.28,P=0.30)。
4.1.3?氟唑帕利相关研究 FZOCUS-3研究[15]应用氟唑帕利治疗既往2~4线含铂化疗的gBRCA突变铂敏感复发EOC患者,结果显示:独立评审委员会(Independent Review Committee,IRC)和研究者评估的ORR分别为69.9%和70.8%;中位PFS时间分别为12.0个月和10.3个月。中位OS时间尚未达到,12个月和18个月OS率分别为93.7%和89.2%。
4.1.4?帕米帕利相关研究?在BGB-290-102研究[16]中,应用帕米帕利治疗既往二线及以上含铂化疗的gBRCA突变的铂敏感复发EOC患者,结果显示:IRC和研究者评估的ORR分别为64.6%和62.2%;IRC评估的中位PFS时间为15.2个月。中位OS时间尚未达到,6个月和12个月OS率分别为93.2%和83.5%。
基于上述研究证据,推荐经二线及以上化疗BRCA突变的铂敏感复发卵巢癌患者可用奥拉帕利单药治疗(2A类);经三线及以上化疗HRD阳性的铂敏感复发卵巢癌患者可用尼拉帕利单药治疗(2B类),铂敏感复发后可用尼拉帕利联合贝伐珠单抗治疗(2B类);经二线及以上化疗BRCA突变的铂敏感复发卵巢癌患者可用氟唑帕利、帕米帕利单药治疗(2B类)。
4.2
铂耐药复发卵巢癌的治疗
铂耐药复发卵巢癌患者对含铂化疗方案一般不再敏感,原则上推荐非铂化疗,但临床反应率有限,多在20%左右。一旦铂耐药复发,患者往往难以治愈,在姑息治疗的同时必须兼顾生活质量,比化疗药物毒性较低的PARP抑制剂对于BRCA突变患者是一种“去化疗”的治疗选择。
4.2.1?奥拉帕利相关研究
4.2.1.1?Study 42研究[6]
对既往接受三线及以上含铂化疗方案的BRCA突变铂耐药复发卵巢癌患者给予奥拉帕利治疗,ORR达31.1%。奥拉帕利是第一个在复发性卵巢癌治疗中表现出临床疗效的PARP抑制剂[52]。
4.2.1.2?CLIO研究[47]
针对铂耐药复发卵巢癌患者,奥拉帕利单药治疗组患者的ORR高于化疗组(18%∶6%),但尚未有统计学意义;亚组分析提示BRCA突变型患者较野生型患者获益显著。
4.2.2尼拉帕利相关研究
4.2.2.1QUADRA研究[11]
尼拉帕利单药治疗铂耐药复发卵巢癌,BRCA突变患者、HRD阳性患者和HRD阴性/未知患者的ORR分别为27%、10%和3%,这提示尼拉帕利对BRCA突变铂耐药复发卵巢癌有一定疗效。
4.2.2.2TOPACIO研究[53]
尼拉帕利联合帕博利珠单抗治疗铂耐药复发/难治性卵巢癌患者的ORR为18%,疾病控制率为65%,治疗效果不受BRCA状态的影响。
4.2.2.3?ANNIE研究[54]
尼拉帕利联合安罗替尼治疗铂耐药复发性卵巢癌疗效可评估者的ORR为55.6%,中位PFS时间为8.3个月。该研究初步表明此种联合治疗可作为耐药复发卵巢癌的一种新选择。
4.2.3帕米帕利相关研究?在BGB-290-102研究[16]中,应用帕米帕利治疗既往二线及以上含铂化疗的gBRCA突变的铂耐药复发EOC,结果显示:IRC和研究者评估的ORR分别为31.6%和26.3%;IRC评估的中位PFS时间为6.2个月。中位OS时间为13.6个月,6个月和12个月OS率分别为73.4%和50.5%。据此,帕米帕利在国内首先获批铂耐药复发卵巢癌后线治疗适应证。
基于以上循证医学较低级别的研究证据,对铂耐药复发卵巢癌患者,推荐奥拉帕利单药治疗经三线及以上化疗的BRCA突变患者(2B类);推荐尼拉帕利用于三线以上BRCA突变患者(2B类);推荐尼拉帕利联合安罗替尼(2B类)、尼拉帕利联合帕博利珠单抗(3类)治疗铂耐药复发性卵巢癌;推荐帕米帕利治疗二线及以上gBRCA突变患者(2B类)。
PARP抑制剂用于一线、二线维持治疗和后线治疗的药物用法见表5。
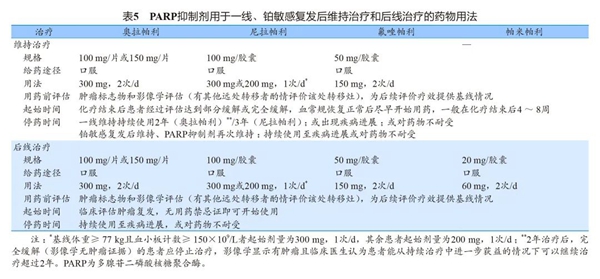
5PARP抑制剂使用的安全性管理
5.1
PARP抑制剂的常见不良反应及其处理
在PARP抑制剂用药过程中,大部分患者会出现不同程度的不良反应,特点如下:①不良反应以轻度或中度为主,即不良事件通用术语标准(common termi­nology criteria for adverse events,CTCAE)毒性分级1~2级更为常见,患者耐受性高于化疗(细胞毒性药物)。②大部分不良反应出现在服药前期(前3个月),随着用药时间的逐渐延长,患者耐受,不良反应的程度逐渐减弱。③PARP抑制剂的不良反应呈现剂量相关性,大部分不良反应通过减量、对症治疗等方法可控制。④血液学、胃肠道不良反应及疲劳最常见。大部分3~4级不良反应为血液学不良反应,且是调整药物剂量、中断和停止用药的最主要原因,0.9%~27.0%的患者因不良反应而终止用药,大部分患者可长期用药维持治疗[9,11,12]。⑤不同PARP抑制剂的药物结构、药代动力学以及代谢途径不完全一致,需要患者关注不同药物毒性特点,更好地进行预防监测和处理。⑥奥拉帕利联合贝伐珠单抗维持治疗毒性与两种药物单独使用毒性并未出现明显的叠加效应,毒性可耐受。奥拉帕利或尼拉帕利联合贝伐珠单抗常见的不良反应为疲劳、恶心、贫血、血小板减少和高血压。3级以上不良反应发生率为48.5%~77.0%,主要为贫血、血小板减少和高血压。需要注意贝伐珠单抗相关高血压的管理。临床医生需要重视PARP抑制剂使用过程中的毒性管理,通过告知使患者对毒性有适当预知,合理地监测和处理,提高患者依从性,并减少用药中断造成的血药浓度波动,提高患者生存质量和疗效。
5.1.1血液学不良反应?使用PARP抑制剂的患者需要每月检查血常规,并建议在开始用药的第1个月内每周检查血常规。
5.1.1.1贫血
贫血是使用PARP抑制剂最常见的血液学不良反应,总体发生率为21.0%~89.4%,3~4级不良反应发生率为5.0%~41.6%。一般处理原则:①血红蛋白水平降至80~100 g/L者,可在监测血常规的情况下继续使用PARP抑制剂,对缺铁、叶酸缺乏患者可补充铁剂和叶酸补充剂,促红细胞生成素需谨慎使用。②血红蛋白水平<80 g/L者,暂停使用PARP抑制剂,对于出现贫血症状的患者必要时采用红细胞输注治疗,待血红蛋白水平恢复至≥90 g/L后,下调一个剂量水平恢复PARP抑制剂使用(常用PARP抑制剂的减量方法见表6,氟唑帕利待血红蛋白恢复至≥80 g/L后恢复用药),恢复用药后每周监测血红蛋白水平至平稳。③如果停药28 d内血红蛋白仍未能恢复至可用药水平,或减量至最低剂量仍再次发生血红蛋白降至80 g/L以下,应停止用药。使用帕米帕利的患者首次发生血红蛋白水平低于90 g/L时,需要暂停用药,治疗直至血红蛋白水平恢复至≥90 g/L,下调一个剂量水平给药。再次发生,适当的支持性治疗或暂停用药后治疗直至血红蛋白水平恢复至≥90 g/L后继续40 mg每日2次剂量水平用药或暂停用药后降至20 mg每日2次剂量水平恢复用药;若贫血危及生命,需紧急治疗:暂停给药并遵医嘱治疗直至血红蛋白水平恢复至≥90 g/L,下调一个剂量水平以20 mg每日2次给药;在20 mg每日2次剂量水平再次出现贫血危及生命,且贫血不是由于其他干扰事件(如胃肠道出血)引起,应停用帕米帕利。
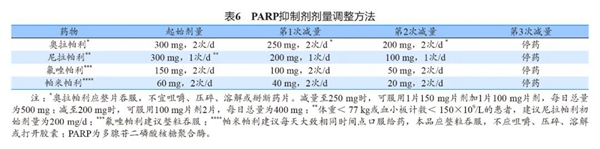
5.1.1.2血小板减少
血小板减少的发生率为14%~61%,3~4级血小板减少的发生率为1%~34%。处理方法:①血小板计数降至(50~100)×109/L患者,可在监测血常规的情况下继续使用PARP抑制剂;②血小板计数<50×109/L者,暂停使用PARP抑制剂,待血小板计数恢复至75×109/L以上(氟唑帕利待小板计数恢复至50×109/L以上),下调一个剂量水平并恢复PARP抑制剂使用;③治疗可使用血小板生成素、白介素-11、血小板生成素受体激动剂等药物。血小板计数低于20×109/L,有出血倾向患者予输注血小板;④如果停药28 d内血小板计数仍未能恢复至可用药水平,或减至用药最低剂量仍再次发生血小板减少,停止用药。
使用尼拉帕利患者:对体重<77 kg或血小板计数<150×109/L的患者,建议尼拉帕利的初始剂量为200 mg/d,监测血小板计数如低于100×109/L者,则暂停使用PARP抑制剂,待血小板计数恢复至100×109/L以上,根据血小板计数的最低值决定恢复使用PARP抑制剂的剂量:如血小板计数最低值为(75~100)×109/L,可原剂量恢复PARP抑制剂使用;如血小板计数最低<75×109/L,或2次以上发生血小板计数<100×109/L,减量恢复PARP抑制剂使用,每周监测血小板计数至平稳。
5.1.1.3中性粒细胞减少
中性粒细胞减少是第3种常见的血液学不良反应,总发生率为5.0%~61.1%,其中4.0%~33.6%为3~4级不良反应。处理方法:①中性粒细胞计数降至(1.0~2.0)×109/L,在监测血常规的情况下可继续使用PARP抑制剂。②中性粒细胞计数<1.0×109/L,暂停使用PARP抑制剂,必要时使用粒细胞刺激因子等药物治疗。待中性粒细胞计数恢复至1.5×109/L以上,下调剂量恢复用药。使用氟唑帕利者待中性粒细胞计数恢复至1.0×109/L以上,首次发生中性粒细胞缺乏且不伴发热可考虑原剂量恢复用药,2次以上发生中性粒细胞缺乏或伴发热,或伴血小板降低至75×109/L以下患者需下调一个剂量水平恢复使用,恢复用药后每周监测中性粒细胞计数至平稳。③中性粒细胞减少治疗可考虑使用短效重组人粒细胞集落刺激因子,如果停药28 d内中性粒细胞计数仍未恢复至可用药水平,或减至用药最低剂量仍再次发生中性粒细胞计数降低至1.0×109/L以下,应停止用药。
5.1.2非血液学不良反应
5.1.2.1胃肠道不良反应
恶心是最常见的胃肠道不良反应,发生率为48.0%~73.6%。其他常见胃肠道不良反应包括便秘、呕吐和腹泻,1~2级不良反应多见。预防和管理:①告知患者发生恶心等胃肠道症状的可能性较大,给患者合理的预期;②对症治疗,可以参照细胞毒药物化疗引起胃肠道不良反应的管理,可使用胃肠动力药、5-羟色胺受体拮抗剂等止吐药物,必要时在睡前30~60 min服用止吐药物,注意服用奥拉帕利时应避免使用阿瑞匹坦等神经激肽-1(neurokinin-1,NK-1)抑制剂(CYP3A4抑制剂),PARP抑制剂在睡前服用有助于减少恶心的发生;③暂停PARP抑制剂用药及减量:CTCAE 2级以上不良反应经治疗后未能缓解,或出现3级以上不良反应,需暂停PARP抑制剂用药,直至不良反应降至1级或缓解,恢复PARP抑制剂用药时要考虑减量(特别是第2次暂停用药后)。PARP抑制剂剂量已减至最低、不良反应症状仍持续的患者要停止用药。
5.1.2.2疲劳
疲劳是常见的不良反应,29.2%~66.0%使用PARP抑制剂的患者有疲劳症状,大部分为1~2级症状,3级以上的疲劳症状发生率小于10%。预防和管理:①给患者合理的预期,告知可能发生的疲劳症状;②对症治疗,必要的镇痛、抗抑郁治疗;③非药物干预,认知行为疗法和营养咨询;④如果疲劳仍然持续,出现CTCAE 2级以上不良反应,且处理后无法缓解,或出现3级以上不良反应,应暂停用药。待症状改善后原剂量或减量(特别是第2次暂停用药后)继续用药。对于剂量已减至最低、疲劳症状仍难以控制的患者要考虑停止用药。
5.1.2.3其他不良反应
几种PARP抑制剂均有头痛(5.3%~30.0%)和失眠(5.6%~31.4%)的报道,多为1~2级不良反应。较少出现的不良反应包括呼吸困难、鼻咽炎、咳嗽;高血压、心动过速和心悸;以及偶有患者出现血清肌酐水平升高。其他报道的不良反应包括关节痛和背痛。对于非血液学毒性处理原则如下:1~2级不良反应,可在对症治疗、监护情况下继续使用PARP抑制剂;对3级及以上不良反应,需要暂停用药,处理待不良反应降至1级以下再恢复用药,并考虑减量,如已减至最低剂量,症状仍持续超过28 d考虑终止用药。
5.1.3?继发恶性肿瘤?在使用PARP抑制剂相关临床研究中少数患者可发生继发性恶性肿瘤(骨髓增生异常综合征或急性髓系白血病),发生率为0~8%(安慰剂组发生率为0~4%),通常发生于长期治疗后,是严重的不良事件。需要指出所有发生骨髓增生异常综合征或急性髓系白血病患者除PARP抑制剂外,之前均接受过铂类等DNA损伤药物治疗,部分患者还存在骨髓发育不良或其他原发性恶性肿瘤病史,难以完全归结于PARP抑制剂的使用。如果患者在使用PARP抑制剂时出现难以改善的全血细胞减少,排除如营养缺乏或病毒感染等原因者,应转诊血液科进行骨髓穿刺检查,一旦诊断为骨髓增生异常综合征或急性髓系白血病,必须立即停用PARP抑制剂。
5.2
PARP抑制剂与其他药物的相互作用
几种PARP抑制剂的代谢途径不同,尼拉帕利主要通过羧酸酯酶代谢,奥拉帕利、氟唑帕利和帕米帕利主要通过细胞色素P450酶途径代谢,其中奥拉帕利和氟唑帕利通过CYP3A酶代谢,帕米帕利主要通过CYP2C8和CYP3A酶代谢。因此,在服用奥拉帕利、氟唑帕利时,不推荐合并使用强效CYP3A抑制剂(如伊曲康唑、克拉霉素、酮康唑、伏立康唑等)或中效CYP3A抑制剂(如阿瑞匹坦、环丙沙星、克唑替尼、氟康唑、伊马替尼等),如果必须合并使用,PARP抑制剂需要减量。此外,强效CYP3A诱导剂(如苯妥英、利福平、卡马西平等)可能导致奥拉帕利等药物血药浓度降低,也应避免与奥拉帕利等PARP抑制剂同时使用。在奥拉帕利、氟唑帕利治疗期间,应告知患者避免食用含有CYP3A抑制剂的食物,如西柚、西柚汁、酸橙和酸橙汁。帕米帕利与CYP3A抑制剂合用无需调整剂量,而与CYP2C8抑制剂或诱导剂合用尚无数据,应该慎用。尼拉帕利主要通过羧酸脂酶代谢,该酶不是主要的药物代谢酶,与其他药物的交互作用较少,但亦缺乏相关数据。
6结语
PARP抑制剂是在HRD基础上通过“合成致死”效应发挥抗肿瘤作用的靶向药物,它的问世改变了卵巢癌的治疗模式,使维持治疗成为卵巢癌全程管理的重要组成部分,具有里程碑式的意义。多项随机对照研究表明,对于新诊断的晚期高级别浆液性和子宫内膜样卵巢癌初始化疗后达到CR或PR的患者,应用PARP抑制剂一线维持治疗可显著延长PFS时间,特别是对于BRCA基因突变或/和HRD阳性的患者疗效更加显著。对于铂敏感复发的卵巢癌患者达到CR或PR后应用PARP抑制剂维持治疗可使全人群PFS显著获益,甚至OS显著获益。PARP抑制剂目前主要用于卵巢癌治疗缓解后的维持治疗,但亦可用于复发性卵巢癌的后线治疗,作为“去化疗”的治疗药物仅推荐用于BRCA突变或/和HRD阳性患者。PARP抑制剂总体上药物毒性反应低于细胞毒性化疗药物,但仍需对其血液学和非血液学毒性进行严格管理,除了及时处理贫血、血小板减少、疲劳等常见不良反应外,对少见的骨髓增生异常综合征和急性髓系白血病亦应引起重视。临床上应严格掌握PARP抑制剂用药适应证,推荐用药前常规检测BRCA基因突变,有条件者进行HRD检测,以精准指导临床用药、评估预后。临床医生应了解PARP抑制剂药代动力学特点、配伍禁忌、耐药产生等问题,关注用药依从性,加强卵巢癌长期治疗管理。
图片
指南执笔人
孔北华、刘继红、黄鹤、王新宇、鹿欣
李宁、姜洁、张瑜、高庆蕾、张国楠
梁志清、向阳、崔恒、谢幸、马丁
指南专家组成员(以姓氏笔画为序):
万小平?上海市第一妇婴保健院
马?丁?华中科技大学同济医学院附属同济医院
王丹波?辽宁省肿瘤医院
王世宣?华中科技大学同济医学院附属同济医院
王建六?北京大学人民医院
王新宇?浙江大学医学院附属第一医院
孔北华?山东大学齐鲁医院
吕卫国?浙江大学医学院附属妇产科医院
曲芃芃?天津市中心妇产科医院
向?阳?中国医学科学院北京协和医院
刘继红?中山大学肿瘤防治中心
李?宁?中国医学科学院肿瘤医院
杨兴升?山东大学齐鲁医院
杨佳欣?中国医学科学院北京协和医院
吴小华?复旦大学附属肿瘤医院
吴令英?中国医学科学院肿瘤医院
汪?辉?浙江大学医学院附属妇产科医院
沈?铿?中国医学科学院北京协和医院
宋?坤?山东大学齐鲁医院
张?瑜?中南大学湘雅医院
张国楠?四川省肿瘤医院
陈?刚?华中科技大学同济医学院附属同济医院
赵?霞?四川大学华西第二医院
哈春芳?宁夏医科大学总医院
姜?洁?山东大学齐鲁医院
徐丛剑?复旦大学附属妇产科医院
高庆蕾?华中科技大学同济医学院附属同济医院
高雨农?北京大学肿瘤医院
郭瑞霞?郑州大学第一附属医院
黄?鹤?中山大学肿瘤防治中心
崔?恒?北京大学人民医院
康?山?河北医科大学第四医院
鹿?欣?复旦大学附属妇产科医院
梁志清?陆军军医大学第一附属医院
程文俊?江苏省人民医院
谢?幸?浙江大学医学院附属妇产科医院

来源:中华医学会妇科肿瘤学分会. 卵巢癌PARP抑制剂临床应用指南(2022版)[J]. 肿瘤综合治疗电子杂志, 2022, 8(3): 64-77.
