本文刊登于《中国实用妇科与产科杂志》2022,38(7):705-713
DOI:10.19538/j.fk2022070110
【引用本文】中国优生科学协会肿瘤生殖学分会,中国医师协会微无创医学专业委员会妇科肿瘤学组,中国医院协会妇产医院分会妇科肿瘤专业学组.卵巢恶性肿瘤保留生育功能的中国专家共识(2022年版)[J].中国实用妇科与产科杂志,2022,38(7):705-713.
作者:中国优生科学协会肿瘤生殖学分会 中国医师协会微无创医学专业委员会妇科肿瘤学组 中国医院协会妇产医院分会妇科肿瘤专业学组
基金项目:国家自然科学基金(81960464);广西医疗卫生适宜技术开发与推广应用项目(S2019103)
通讯作者:王玉东,上海交通大学医学院附属国际和平妇幼保健院,上海 200030,电子信箱:owangyudong@126.com;张师前,山东大学齐鲁医院,山东 济南 250012,电子信箱:r370112@126.com;范江涛,广西医科大学第一附属医院,广西 南宁 530021,电子信箱:jiangtao_fan1969@163.com
执笔专家:孙丹(广西医科大学第一附属医院);范江涛(广西医科大学第一附属医院),张师前(山东大学齐鲁医院);王建东(首都医科大学附属北京妇产医院);王玉东(上海交通大学医学院附属国际和平妇幼保健院)
参与共识讨论专家(排名不分先后):孙丹(广西医科大学第一附属医院);范江涛(广西医科大学第一附属医院);张师前(山东大学齐鲁医院);王建东(首都医科大学附属北京妇产医院);王玉东(上海交通大学医学院附属国际和平妇幼保健院);王继东(山东省妇幼保健院);许天敏(吉林大学第二医院);蔡红兵(武汉大学中南医院);贺红英(广西医科大学附属柳铁中心医院);李长忠(北京大学深圳医院);娄阁(哈尔滨医科大学附属肿瘤医院);陆琦(复旦大学附属金山医院);孙阳(福建省肿瘤医院);孙蓬明(福建省妇幼保健院);王平(四川大学华西二院);王武亮(郑州大学第二附属医院);邹冬玲(重庆大学附属肿瘤医院);王莉(河南省肿瘤医院);王延洲(陆军军医大学第一附属医院);吴强(江苏省肿瘤医院);于浩(山东第一医科大学附属肿瘤医院);董延磊(山东大学第二医院);杨英捷(贵州省肿瘤医院);张颐(中国医科大学附属第一医院);王颖梅(天津医科大学总医院);师伟(山东中医药大学附属医院);王刚(四川省妇幼保健院);王小元(山东第一医科大学第一附属医院);韦德英(山东第一医科大学附属省立医院);程晓东(浙江大学医学院附属妇产科医院);阳志军(广西医科大学附属肿瘤医院);任琛琛(郑州大学第三附属医院);沈杨(东南大学附属中大医院);谭文华(哈尔滨医科大学第二附属医院);孔为民(首都医科大学附属北京妇产医院);李斌(中国医学科学院肿瘤医院);张国楠(四川省肿瘤医院);马晓欣(中国医科大学附属盛京医院);林蓓(中国医科大学附属盛京医院);王沂峰(南方医科大学珠江医院);李俊东(中山大学肿瘤医院);刘淑娟(空军军医大学西京医院);熊光武(北京大学国际医院);洪莉(武汉大学人民医院);王丹波(辽宁省肿瘤医院);郭瑞霞(郑州大学第一附属医院);朱前勇(河南省人民医院);陆安伟(南方医科大学深圳医院);王静(湖南省肿瘤医院);王永军(北京大学第四临床医学院);王世军(首都医科大学北京宣武医院);魏代敏(山东大学附属生殖医院);黄守国(中南大学湘雅海口医院);符淳(中南大学湘雅第二医院);纪妹(郑州大学第一附属医院);蔡丽萍(南昌大学第一附属医院);王建六(北京大学人民医院);孟元光(解放军总医院妇产医学部);覃爱平(广西医科大学第一附属医院);刘畅(兰州大学第一医院);唐均英(重庆医科大学附属第一医院);周圣涛(四川大学华西第二医院)
1、背景
卵巢恶性肿瘤患者中育龄期女性约占12%[1],在全球范围内,每年15~40岁年龄段女性新增卵巢恶性肿瘤约38 500例[2]。近年来,随着诊疗手段的不断进步,卵巢恶性肿瘤死亡率呈下降趋势[3]。年轻卵巢恶性肿瘤尤其是有生育需求的群体,除关注肿瘤治疗结局外,生活质量和保留生育能力也不容忽视。
卵巢恶性肿瘤保留生育功能的手术(fertility-sparing surgery,FSS)旨在保存患者的正常卵巢和子宫,在保证肿瘤治疗效果的前提下,保留患者的生殖内分泌和生育功能,可否实施FSS主要取决于患者的年龄、生育需求、生育计划、肿瘤组织学类型、病理分级、国际妇产科联盟(FIGO)分期等[4-5]。依据2020年世界卫生组织(WHO)卵巢肿瘤组织病理学分类[6]和2014年卵巢癌-输卵管癌-原发性腹膜癌FIGO分期标准[7],为指导临床实践,以期在不影响肿瘤学结局的前提下,为有生育要求的卵巢恶性肿瘤患者提供保留生育功能的策略,中国优生科学协会肿瘤生殖学分会、中国医师协会微无创医学专业委员会妇科肿瘤学组与中国医院协会妇产医院分会妇科肿瘤专业学组联合组织本领域专家,通过检索文献,专题讨论后制订本共识,以供参考。
本共识推荐级别及其代表意义见表1。

2、卵巢恶性肿瘤保留生育功能的手术治疗
2.1 早期上皮性卵巢癌
推荐及共识:早期上皮性卵巢癌的标准术式是全面分期手术。满足下列条件者,可考虑保留生育功能:(1)年龄<40岁,渴望生育,不存在其他不孕不育的因素,无妊娠禁忌证。(2)有严格的随诊条件。(3)患者对FSS带来的肿瘤复发风险充分知情。(4)病理提示病变仅限于一侧卵巢,子宫和对侧卵巢无异常(2A类推荐)。(5)ⅠA期低级别浆液性癌、黏液性癌、高级别浆液性癌、透明细胞癌、子宫内膜样癌(2A类推荐)。(6)ⅠC期(单侧)低级别浆液性癌、ⅠC1~2期(单侧)G1/2黏液性癌、ⅠC期(单侧)G1/2子宫内膜样癌(2B类推荐)。(7)卵巢子宫内膜样癌和卵巢透明细胞癌患者,应排除子宫内膜病变(2B类推荐)。
手术原则和内容:切除患侧附件和肿瘤,保留子宫和对侧附件;高级别浆液性癌、黏液性癌和透明细胞癌患者,推荐对侧卵巢活检术;其余类型上皮性卵巢癌,若对侧卵巢外观无异常,可不活检;盆腔或(和)腹主动脉旁淋巴结切除;盆腔冲洗液细胞学检查、可疑或粘连部位腹膜多点活检、大网膜活检或切除等全面分期手术。以上均为2A类推荐。
解读:上皮性卵巢癌占卵巢恶性肿瘤的90%,约3%~14%发生于育龄期女性,50%以上的育龄期患者为早期[8]。主要病理类型为高级别浆液性癌(70%)、子宫内膜样癌(10%)、透明细胞癌(10%)、低级别浆液性癌(<5%)和黏液性癌(3%)[9]。高级别浆液性癌预后差,确诊时大多为 Ⅲ 期(51%)或 Ⅳ 期(29%),58%~64%的子宫内膜样癌、黏液性癌和透明细胞癌诊断时为Ⅰ 期。浆液性癌患者的 5 年肿瘤特异性生存率(cancer specific survival,CSS)为 43%,显著低于子宫内膜样癌(82%)、黏液性癌(71%)和透明细胞癌(66%)[3]。肉眼判定的“早期”上皮性卵巢癌,经全面分期手术后,约有30%的患者分期升级[10]。完成生育后视情况可能需再次手术切除子宫及对侧附件[11]。
高级别浆液性卵巢癌保留生育功能的指征存在争议。2021年中国卵巢恶性肿瘤诊断与治疗指南[12]指出“FSS限于分化好的ⅠA期或ⅠC期上皮性卵巢癌患者”,并未包括高级别浆液性卵巢癌,但2022年第1版美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[10]并未排除高级别浆液性卵巢癌,可见高级别浆液性卵巢癌并非FSS的绝对禁忌。高级别浆液性卵巢癌是上皮性卵巢癌中预后最差的类型[13],死于高级别浆液性卵巢癌的人数占所有卵巢恶性肿瘤的70%~80%[14],80%的患者会出现复发[15],为此FSS应十分谨慎,对于选择FSS的患者,推荐健侧卵巢活检术。有证据证实,组织学分级显著影响Ⅰ期上皮性卵巢癌FSS患者的肿瘤预后[11]。ⅠA期G3级与ⅠA期G1/2级相比,5年总体生存率(overall survival,OS)均为100%,但无复发生存率(recurrence-free survival,RFS)显著下降(33.3% vs. 97.8%);ⅠC期G3级与ⅠC期G1/2级相比,5年OS(66.7% vs. 96.9%)和RFS(66.7% vs. 92.1%)均显著下降[11]。该研究指出,Ⅰ期G1/2级上皮性卵巢癌患者FSS是安全的[11]。Fruscio等[16]认为,FSS可能不增加G3级患者的复发风险,也有学者认为根治术并未降低G3级患者复发的概率[17]。因此,仅ⅠA期高级别浆液性卵巢癌可谨慎选择FSS,术后化疗3~6个疗程,ⅠC期患者不推荐保留生育功能。
低级别浆液性卵巢癌占所有上皮性卵巢癌的2%,占浆液性卵巢癌的4.7%,较为罕见,仅2%~5%的患者确诊时为Ⅰ期[18]。肿瘤细胞表现为轻至中度的异质性,增殖活性低[18],但约95%的肿瘤存在雌激素受体表达,50%的肿瘤存在孕激素受体表达,这为治疗提供了潜在靶点[19]。年龄是影响低级别浆液性卵巢癌患者预后的危险因素,年龄大于35岁患者的无病生存期(disease free survival,DFS)明显短于年轻患者(32.6个月 vs. 18.8个月)[20]。但总体来说,低级别浆液性卵巢癌患者的生存期较高级别浆液性卵巢癌患者明显延长,疾病进展缓慢,是上皮性卵巢癌中预后最好的组织学类型之一[13]。因此,有生育需求的ⅠA期和ⅠC期低级别浆液性卵巢癌患者,可以选择FSS。
子宫内膜异位症相关卵巢癌中,最常见的组织学类型为卵巢透明细胞癌和子宫内膜样癌。卵巢透明细胞癌被认为是高级别肿瘤[10],亚裔女性发病率最高,在年轻时达到高峰[3],恶性程度高。有研究指出,对于接受FSS的上皮性卵巢癌患者,高级别或透明细胞癌是影响DFS和CSS的独立危险因素[21]。研究证实,ⅠA期透明细胞癌患者可以选择FSS,但术后应规范化疗[22-23],选择FSS的ⅠC期透明细胞癌患者较接受根治性手术患者的OS更低[1],故不推荐ⅠC期透明细胞癌患者选择FSS[22]。若患者有强烈的意愿,也应十分谨慎,并推荐健侧卵巢活检术,术后完善以铂为基础的化疗。卵巢透明细胞癌患者FSS的临床研究十分有限,FSS的安全性并不确定,应与患者充分沟通并获得明确知情同意。一项基于28 118例上皮性卵巢癌患者的回顾性研究发现,卵巢子宫内膜样癌是上皮性卵巢癌中预后最好的组织学类型之一[13],5年OS为81%,5年无进展生存率(progression-free survival,PFS)为55%;其中低级别子宫内膜样癌5年OS为89%,高级别子宫内膜样癌5年OS为76%[24]。高级别子宫内膜样癌约占卵巢恶性肿瘤的1.6%,预后更差,OS虽比浆液性卵巢癌更长,但短于低级别子宫内膜样癌[25]。因此,不推荐高级别卵巢子宫内膜样癌患者选择FSS。有证据指出,相比浆液性卵巢癌患者,子宫内膜异位症相关卵巢癌患者合并同期原发癌的可能性更大(23.8% vs. 8.3%),而同期原发癌中有94.1%是子宫内膜样癌[25]。因此,卵巢透明细胞癌或卵巢子宫内膜样癌患者,应同时注意排除子宫内膜的病变。另外,卵巢子宫内膜异位症恶变者,易合并其他不孕相关因素,妊娠概率相对较低,患者应充分知情,明确同意[26]。
黏液性卵巢癌好发于20~40岁女性,早期患者预后良好,但需要与卵巢良性、交界性和转移性黏液性癌进行鉴别。一项回顾性研究指出,ⅠA期和ⅠC1~ⅠC2期黏液性卵巢癌患者保留生育功能是可行的,并且肿瘤结局良好,但ⅠC3期的安全性尚不明确[27],故本共识不推荐ⅠC3期黏液性卵巢癌患者FSS。80%的黏液性卵巢癌为转移性癌,其中45%来源于胃肠道,也可来源于子宫颈等部位[28]。因此,即便对侧卵巢外观正常,仍推荐行卵巢活检术以排除微小转移病灶。准确区分原发性与转移性,是黏液性卵巢癌开展FSS的重要前提,不推荐转移性黏液性卵巢癌保留生育功能。
早期上皮性卵巢癌保留生育功能手术及辅助化疗方案,处理流程见图1。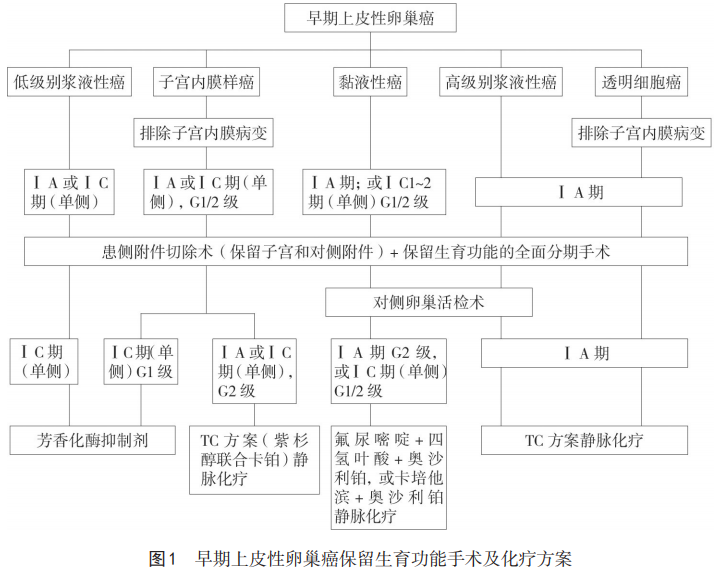
2.2 卵巢恶性生殖细胞肿瘤
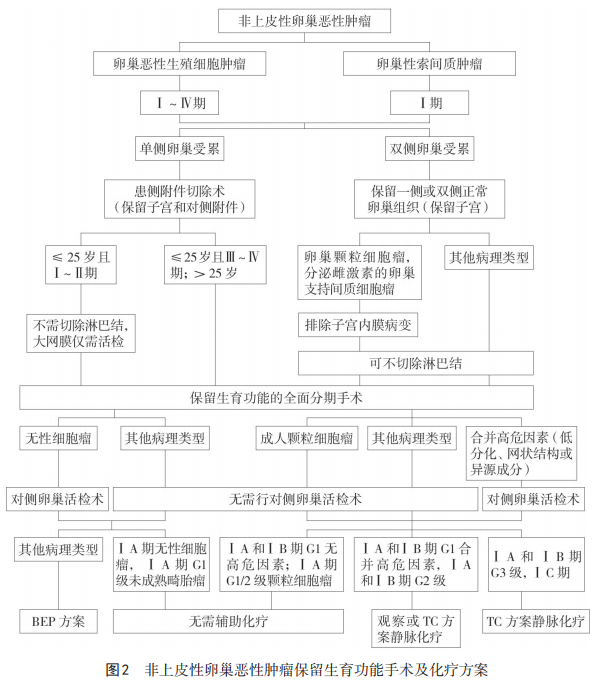
推荐及共识:有生育要求的卵巢恶性生殖细胞肿瘤患者,FSS实施原则包括:(1)年龄<40岁,渴望生育,不存在其他不孕不育的因素,无妊娠禁忌证。(2)有严格的随诊条件。(3)患者对FSS带来的肿瘤复发风险充分知情。(4)单侧卵巢受累者,推荐患侧附件切除术;双侧卵巢受累者,可保留一侧或双侧正常卵巢组织(保留子宫);其余同保留生育功能的全面分期手术(2A类推荐)。(5)除无性细胞瘤外,不建议对外观正常的一侧卵巢进行活检。(6)儿童、青春期和年轻成人(≤25岁)卵巢恶性生殖细胞肿瘤患者不需切除淋巴结,大网膜仅需活检(2A类推荐)。(7)由于预后良好,完成生育后不建议接受根治性手术(2A类推荐)。
解读:卵巢恶性生殖细胞肿瘤好发于年轻女性,确诊的年龄是16~20岁,70%的患者确诊时为Ⅰ期[29]。主要组织学类型包括无性细胞瘤、卵黄囊瘤、未成熟畸胎瘤、胚胎癌、绒癌等[6]。该类肿瘤具有如下特点:多为单侧;对BEP方案(博来霉素+依托泊苷+顺铂)化疗敏感;切除对侧正常卵巢和子宫并不改善预后;有特异的肿瘤标志物;复发和转移多不累及子宫及对侧附件。一项系统综述纳入了47项研究共计2189例卵巢恶性生殖细胞肿瘤患者,接受FSS的累积复发率仅为8.7%[30]。无性细胞瘤患者可能同时存在对侧卵巢隐匿性病变,有研究报道约有11.76%(2/17)的无性细胞瘤患者存在外观正常的卵巢隐匿性受累[31],建议对外观正常的卵巢进行活检。早期和晚期卵巢恶性生殖细胞肿瘤患者FSS后预后良好,Ⅰ期患者5年DFS为84%,Ⅱ~Ⅳ期为89%;Ⅰ期患者5年OS为99%,Ⅱ~Ⅳ期为91%[32]。FIGO分期不是影响FSS术式选择的主要因素。因此,本共识主要依据单侧或双侧卵巢受累,来选择FSS术式。对于双侧卵巢受累的年轻女性,可通过保留部分正常卵巢组织来实现保留生育功能的需求。
卵巢恶性生殖细胞肿瘤保留生育功能手术及辅助化疗方案,处理流程见图2。
2.3 早期卵巢性索间质肿瘤
推荐及共识:满足下列条件者,可考虑保留生育功能:(1)年龄<40岁,渴望生育,不存在其他不孕不育的因素,无妊娠禁忌证。(2)有严格的随诊条件。(3)患者对FSS带来的肿瘤复发风险充分知情。(4)Ⅰ期。(5)单侧卵巢受累者,推荐患侧附件切除术;双侧卵巢受累者,可保留一侧或双侧正常卵巢组织(保留子宫);并进行保留生育功能的全面分期手术,可不切除淋巴结(2A类推荐)。(6)成人型颗粒细胞瘤患者,对侧卵巢外观正常时,无需活检(2A类推荐)。(7)合并高危因素(低分化、网状结构或异源成分)的支持间质细胞肿瘤,建议对外观正常的卵巢进行活检(2A类推荐)。(8)颗粒细胞瘤和分泌雌激素的支持间质细胞瘤,应注意排除子宫内膜病变。(9)卵巢性索间质肿瘤患者完成生育后可考虑接受根治性手术(2B类推荐)。
解读:卵巢性索间质肿瘤为低度恶性肿瘤,64%的患者确诊时为Ⅰ期,Ⅰ期患者预后良好,复发风险≤5%,5年CSS为98%,Ⅳ期患者CSS仍可达41%[3,33]。患者完成生育后可考虑接受根治性手术[10,12]。颗粒细胞瘤和支持间质细胞瘤是卵巢性索间质肿瘤中较常见的病理类型。颗粒细胞瘤多为单侧卵巢受累,仅2%~8%的病例为双侧,可合并子宫内膜增生性疾病或子宫内膜样癌,健侧卵巢无需常规进行活检,但应注意排除子宫内膜病变。颗粒细胞瘤可发生晚期复发,建议延长随访时间或完成生育后行根治性手术。卵巢支持间质细胞瘤多为单侧卵巢受累,约75%的患者年龄小于30岁,2020年WHO卵巢肿瘤组织病理学分类,将其分为高分化型、中分化型、低分化型和网状型[6],其中低分化卵巢支持间质细胞瘤是低度恶性肿瘤,约70%~85%的患者合并雄激素过高的临床表现;部分可合并雌激素过高的表现,如不规则阴道流血、月经过多等,同样应注意排除子宫内膜病变;也有部分病例可不表现出性激素异常[4]。有研究表明,ⅠA期卵巢支持间质细胞瘤患者FSS术后复发率为8%,根治性手术患者的复发率为6%,但复发后死亡的风险高达70%[34]。影响卵巢支持间质细胞瘤预后的高危因素主要有FIGO分期、肿瘤分化程度、网状结构和异源成分[4,35]。故建议对合并有高危因素的卵巢支持间质细胞瘤患者外观正常的卵巢进行活检,以减少复发概率。
卵巢性索间质肿瘤保留生育功能手术及辅助化疗方案,处理流程见图2。
3 FSS术后的辅助治疗
化疗对于女性生育力影响相关因素包括年龄、化疗药物种类及剂量等。规范化疗可以降低肿瘤复发与未控率。FSS后化疗应尽量选择生殖毒性低、对卵巢功能影响小的药物(2B类推荐)。烷化剂尤其是环磷酰胺对卵泡和颗粒细胞的毒性作用最强,存在剂量依赖性,引起早发性卵巢功能不全(POI)和不孕症的风险最高[36]。个别研究认为,化疗还可能通过损伤子宫内膜而影响女性生育能力[37],但不同种类的化疗药物对子宫内膜的影响尚不明确。肿瘤治疗过程中使用促性腺激素释放激素激动剂(GnRH-a)对生育结局的益处仍存在争议。作为辅助治疗,不推荐GnRH-a作为卵巢组织冷冻、卵母细胞冷冻或胚胎冷冻的替代方案[38-39]。当无其他保留生育功能的方法可以选择,或急需开始化疗时,可以考虑选择GnRH-a(3类推荐)。化疗药物对卵巢功能有不同程度的损伤,需慎重考虑[40]。
3.1 早期上皮性卵巢癌
推荐及共识:(1)ⅠA期低级别浆液性癌,ⅠA期G1黏液性癌,ⅠA期G1级子宫内膜样癌,无需辅助化疗。(2)ⅠA期透明细胞癌可观察或酌情给予3~6个疗程化疗。(3)ⅠA期G2级黏液性癌和子宫内膜样癌,可观察或酌情给予3~6个疗程化疗。(4)ⅠC期低级别浆液性癌、G1/2级黏液性癌、G1/2级子宫内膜样癌,化疗3~6个疗程。(5)推荐方案是TC方案;黏液性卵巢癌首选氟尿嘧啶+四氢叶酸+奥沙利铂,或卡培他滨+奥沙利铂静脉化疗;低级别浆液性癌或G1子宫内膜样癌首选芳香化酶抑制剂(阿那曲唑、来曲唑、依西美坦)。以上均为2A类推荐。
解读:辅助化疗应在FSS和全面分期手术的基础上。卡铂具有性腺毒性[41],紫杉醇的性腺毒性尚存在争议[42]。Fornier等[43]指出,紫杉醇对化疗后闭经的影响并不大。有研究发现,紫杉醇对大鼠卵巢的毒性仅限于对窦卵泡的影响,用药6个动情周期内,对卵巢功能无影响[44],但也有文献报道紫杉醇可导致卵泡刺激素(FSH)增高[45]。TC方案的性腺毒性尚不明确。有研究指出,TC方案可诱导小鼠蓄积性卵巢损伤和不孕症[46]。一项基于2325例患者的回顾性研究发现,Ⅰ期卵巢透明细胞癌患者总体上可从化疗中获益,ⅠA和ⅠB期患者接受化疗后OS可得到改善[47]。该研究未针对FSS患者进行独立分析,因此对于接受了FSS的ⅠA期透明细胞癌患者化疗后的肿瘤结局尚不明确。
不同类型的上皮性卵巢癌的一线化疗方案有所不同,ⅠA期黏液性卵巢癌术后可观察,ⅠC期术后可以选择观察或化疗。ⅠA期G1卵巢子宫内膜样癌术后可观察,ⅠC期术后可选择观察、化疗或激素治疗;ⅠC期术后选择化疗者,化疗后可观察或来曲唑及其他激素维持治疗[10]。
3.2 卵巢恶性生殖细胞肿瘤
推荐及共识:(1)对ⅠA期无性细胞瘤和ⅠA期G1未成熟畸胎瘤,在实施保留生育功能的全面分期手术后,可随访观察。(2)其他临床期别者,在分期手术或满意的肿瘤细胞减灭术后,都应接受3~4个疗程化疗,或在血清肿瘤标志物检测正常后再化疗2个疗程。(3)化疗方案首选BEP方案,无性细胞瘤可选择EP方案(依托泊苷+顺铂)。以上均为2A类推荐。(4)Ⅰ期患者推荐3个周期化疗,Ⅱ期及以上推荐4个周期化疗(2B类推荐)。(5)不能因保留生育能力而延迟化疗(2B类推荐)。
解读:非上皮性卵巢恶性肿瘤患者的生殖功能几乎不受化疗影响[48]。BEP方案化疗后 95%~100%的患者恢复正常月经[48-49]。有文献报道化疗对卵巢恶性生殖细胞肿瘤患者FSS术后卵巢功能的影响,1111例患者中仅3.7%出现卵巢早衰[30]。但有研究指出,以顺铂为基础的化疗可增加约18%女性不孕的风险[50]。顺铂对卵母细胞DNA的损伤可能导致胚胎染色体异常和早期胚胎死亡[51-52]。博来霉素对肺功能造成不可逆性损害,总剂量不应超过360 mg,特别对于儿童青少年患者更值得关注。化疗对于肿瘤结局至关重要,不能因保留生育能力而延迟化疗。
3.3 早期卵巢性索间质肿瘤
推荐及共识:(1)Ⅰ A和ⅠB期G1无高危因素(异源成分或网状结构)者,无需辅助化疗(2A类推荐)。(2)ⅠA和ⅠB期G1级合并高危因素者,或ⅠA和ⅠB期G2级,可观察或酌情给予3~6个疗程化疗(2B类推荐)。(3)ⅠA和ⅠB期G3级,或ⅠC期,需给予3~6个疗程化疗(2A类推荐)。(4)ⅠA期G1/2级卵巢颗粒细胞瘤无需辅助化疗(2B类推荐)。(5)首选TC方案,备选EP方案(2A类推荐)。
解读:早期卵巢性索间质肿瘤患者是否需要辅助化疗存在争议[4]。一项纳入了160例Ⅰ期卵巢颗粒细胞瘤患者的回顾性研究发现,与ⅠA期相比,ⅠC期患者复发率更高(43% vs. 24%),中位复发时间更短(10.2年 vs. 16.2年);该研究还指出,无论复发与否,Ⅰ期颗粒细胞瘤患者中位OS相近,且均超过20年,认为术后化疗并未延长OS,选择化疗时应谨慎[41]。Ⅰ期卵巢支持间质细胞瘤合并低分化或异源成分者,术后需进行辅助化疗[4]。推荐Ⅰ期低危卵巢性索间质肿瘤患者术后观察,Ⅰ期高危(肿瘤破裂、ⅠC期、分化差)或Ⅰ期中危(有异源成分)者可选择观察或以铂类为基础的联合化疗[10]。
4、生育力评估及遗传咨询
4.1 生育力评估
推荐及共识:(1)妇科肿瘤医生应联合生殖科医生,向FSS患者及其配偶或家长,提供保留生育能力的医学支持。(2)生育力评估应分别在术前、术中和术后进行。(3)女性生育力评估主要包括:一般情况和病史(年龄、生活方式和生活环境、遗传背景、是否合并其他基础疾病)、卵巢储备功能、有无排卵障碍。卵巢储备功能评估主要指标包括:年龄、抗米勒管激素(AMH)、窦卵泡计数(AFC)、基础卵泡刺激素(FSH)、雌二醇(E2)、抑制素B(Inhibin-B)、卵巢体积等。评估有无排卵障碍主要包括:月经周期是否规律、超声监测排卵、黄体中期孕酮水平等。FSS手中可行输卵管通畅度检查。若术前即为不孕症患者,可在术中再次评估输卵管、卵巢情况。(4)推荐术前与生殖医生协商考虑术中卵巢组织冻存的可能性及必要性。(5)术后评估的时机选择需要根据术后病理情况确定,如需要进一步化疗者,可延迟评估。以上均为2A类推荐。
解读:肿瘤患者在接受抗肿瘤治疗后,约80%的患者面临生育能力下降问题[53]。对于有生育需求的女性,因肿瘤治疗而丧失生育能力,对患者生活质量将造成严重影响[54]。但仅有4%~20%的女性在抗肿瘤治疗的同时,获得了保留生育能力的支持[54]。建议采用AMH和AFC评估卵巢储备功能,预测卵巢对刺激的反应程度[55]。应评估化疗对性腺损害的风险,可结合年龄、化疗药物类型和剂量、以及化疗前AMH水平预测化疗后POI的风险[55-57]。建议启动FSS前,对患者和配偶的生育能力进行评估。充分告知患者和配偶(或家长)卵巢恶性肿瘤的手术治疗和(或)辅助治疗对生育能力的影响。若患者和配偶合并不孕症或不育症,应同时提供诊疗建议。生育力保留和保护应与良好的肿瘤预后达到最佳平衡,夫妻双方在开始FSS之前应全面了解风险与获益,并取得明确知情同意。
4.2 遗传咨询
推荐及共识:(1)推荐对所有诊断卵巢恶性肿瘤的患者进行基因检测。(2)应为患有遗传性乳腺癌和卵巢癌综合征(HBOC)、林奇综合征(lynch syndrome)等遗传性癌症综合征的女性提供遗传咨询。(3)对于检出胚系突变患者,需进一步对其家系进行“逐级检测”。(4)接受FSS患者在完成生育后,建议对BRCA突变携带者及林奇综合征患者进行全面分期手术。以上均为1类推荐。
解读:卵巢恶性肿瘤尤其是高级别浆液性癌最主要的危险因素为卵巢癌或者乳腺癌家族史[58]。有家族史的卵巢恶性肿瘤患者,约40%的患者伴有BRCA1/2基因突变[59]。非上皮性卵巢癌通常与非BRCA1/2基因突变有关[60-62],约有60%的支持间质细胞瘤病例合并DICER1基因突变,多见于中低分化支持间质细胞瘤患者[63]。因此,推荐对所有卵巢恶性肿瘤患者行基因检测。对癌症易感基因的评估是提供个体化治疗和个体化随访策略的重要组成部分。携带癌症易感基因的患者可通过胚胎植入前遗传学检测(preimplantation genetic test,PGT)筛选不携带癌症易感基因的胚胎移植,从而避免子代患遗传性癌症的风险。对于携带BRCA1/2突变的女性,行双侧卵巢-输卵管切除术可将卵巢恶性肿瘤的风险降低约80%[64],口服避孕药可将卵巢恶性肿瘤风险降低约50%,对于暂时无生育需求且合并BRCA1/2突变的育龄期女性,可考虑使用口服避孕药[65]。另外,BRCA突变可能对卵巢储备和生育能力产生负面影响[66],更容易发生化疗引起的卵巢储备功能下降[67]。有研究指出,BRCA突变导致的DNA修复缺陷可能会使卵母细胞更容易遭受DNA损伤,是导致卵巢储备功能下降的主要原因[68-69]。BRCA突变患者需要在生育力保存前对适应证和风险进行多学科团队综合评估[70]。林奇综合征是一种罕见的遗传性疾病,与结直肠癌、子宫内膜癌、卵巢恶性肿瘤和其他癌症的风险增加有关。因此,推荐接受FSS的林奇综合征患者,在完成生育后进行全面分期手术[65]。
5、FSS后妊娠和随访相关问题
推荐及共识:(1)在严密监测下,FSS术后择期尝试妊娠。(2)因化疗药物的生殖毒性,建议完成化疗后间隔6~12个月方可妊娠。(3)孕期仍需密切监测妊娠和肿瘤复发情况。(4)FSS术后未能完成生育,患者仍有生育需求时,应动态综合评估肿瘤复发风险和生育能力,及时给予肿瘤治疗和生育指导。(5)随访应从FSS后开始,包括肿瘤复发风险评估、生育能力评估、手术和(或)辅助治疗的并发症评估等。以上均为2B类推荐。
解读:FSS术后和FSS术后化疗后的最佳妊娠时机目前尚无统一意见。术后早期妊娠有肿瘤复发可能,多数卵巢恶性生殖细胞肿瘤在术后2年内复发[71],卵巢性索间质肿瘤患者的中位复发时间为4~6年[33];术后延迟妊娠,会因输卵管粘连、患者年龄增大等因素降低生育力。有学者建议,当FSS术后无需化疗时,可在严密监测随访下于术后3~6个月尝试妊娠,若FSS术后需辅助化疗,可于化疗结束后6~12个月妊娠[72],个别建议妊娠与化疗结束应间隔1年[70]。
上皮性卵巢癌FSS术后妊娠率和活产率的报道有限,总体妊娠率在67%左右[73]。一项基于瑞典人群的回顾性队列研究发现,在57例接受FSS的非上皮性卵巢癌患者中,11例(19%)足月分娩,无先天性畸形发生[74]。我国的一项回顾性队列研究发现,非上皮性卵巢癌患者FSS术后妊娠率为79.5%(35/44),均无出生缺陷,FSS术后辅助化疗对生育能力几无影响,术后妊娠不影响PFS或OS[75]。卵巢恶性生殖细胞肿瘤患者FSS术后妊娠率为67%~100%[32,76-79]。有研究发现,大多数卵巢恶性生殖细胞肿瘤患者FSS术后生育能力正常,妊娠结局与一般人群相当[30]。卵巢性索间质肿瘤患者FSS术后妊娠结局的研究较少,缺乏多中心的研究。Wang等[80]发表了一项回顾性分析,纳入了113例Ⅰ期卵巢颗粒细胞瘤患者,其中61例接受FSS,52例接受根治性手术,两组之间DFS无差异;22例有生育需求的患者接受FSS后的妊娠率为86.4%,活产率为95%。一项对于早期未成熟畸胎瘤FSS术式比较的回顾性研究发现,单侧卵巢-输卵管切除术与卵巢囊肿剥除术的妊娠率均较高(83.3% vs. 85.7%)[81]。
肿瘤复发风险、手术和(或)辅助治疗的并发症和一般情况评估应由妇科肿瘤医生进行。评估内容主要包括:病史询问和体格检查,血常规和生化检查,肿瘤标志物,影像学检查如盆腹腔CT、MRI或PET-CT等。随访间隔应在FSS后第1~2年,每2~4个月1次;第3~5年,每4~6个月1次;5年后,每6~12个月1次。生育能力的动态监测由生殖医学医生完成,完成生育后停止。
本共识的制订基于循证医学证据,旨在为卵巢恶性肿瘤FSS提供规范化指导性意见,但具体方案的实施需高度个体化。部分共识的推荐还需更高质量的临床研究验证。本共识不排除其他学术组织有关指南、共识或建议的合理性。共识制订专家委员会一致声明本共识的制订与任何商家无利益冲突。本共识更新周期拟定2年。
[1] Crafton SM,Cohn DE,Llamocca EN,et al.Fertility-sparing surgery and survival among reproductive-age women with epithelial ovarian cancer in 2 cancer registries[J].Cancer,2020 ,126(6):1217-1224.
[2] International Agency for Research on Cancer(IARC).Global cancer observatory[EB/OL].(2020-11-17).https://gco.iarc.fr.
[3] Torre LA,Trabert B,DeSantis CE,et al.Ovarian cancer statistics,2018[J].CA Cancer J Clin,2018,68(4):284-296.
[4] Ray-Coquard I,Morice P,Lorusso D,et al.Non-epithelial ovarian cancer:ESMO clinical practice guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2018,29(Suppl 4):iv1-iv18.
[5] Shah JS,Guerra R,Bodurka DC,et al.Factors influencing fertility-sparing treatment for gynecologic malignancies:a survey of Society of Gynecologic Oncology members[J].Gynecol Oncol,2017,147(3):497-502.
[6] WHO Classification of Tumours Editorial Board.Female genital tumours--WHO classification of tumours series,5th ed.Vol.4[M].Lyon(France):International Agency for Research on Cancer,2020.
[7] Mutch DG,Prat J.2014 FIGO staging for ovarian,fallopian tube and peritoneal cancer[J].Gynecol Oncol,2014,133(3):401-404.
[8] 马丁.卵巢癌研究进展与规范化治疗[J].中国实用妇科与产科杂志,2021,37(6):601-604.
[9] 邓黎,梁志清.微创手术在卵巢癌治疗中的应用与争议[J].中国实用妇科与产科杂志,2021,37(6):620-623. .
[10] National Comprehensive Cancer Network.NCCN guideline in ovarian cancer/fallopian tube cancer/primary peritoneal cancer(Version 1.2022)[EB/OL].(2022-03-02).https://www.nccn.org/professionals/physician_gls/pdf/ovarian.pdf.
[11] 张师前,魏代敏.重视妇科恶性肿瘤内分泌功能保护及生殖管理[J].中国实用妇科与产科杂志,2019,35(6):612-613.
[12] 中国抗癌协会妇科肿瘤专业委员会.卵巢恶性肿瘤诊断与治疗指南(2021年版)[J].中国癌症杂志,2021,31(6):490-500.
[13] 郭丽,王忱,张萍,等.高级别浆液性卵巢癌的分子遗传学研究进展[J].中国实用妇科与产科杂志,2021,37(9):982-984.
[14] Bowtell DD,B?hm S,Ahmed AA,et al.Rethinking ovarian cancer II:reducing mortality from high-grade serous ovarian cancer[J].Nat Rev Cancer,2015,15(11):668-679.
[15] Matulonis UA,Sood AK,Fallowfield L,et al. Ovarian cancer[J].Nat Rev Dis Primers,2016,2:16061.
[16] Fruscio R,Corso S,Ceppi L,et al.Conservative management of early-stage epithelial ovarian cancer:results of a large retrospective series[J].Ann Oncol,2013,24(1):138-144.
[17] 周灿权,黄孙兴.重视女性生育力的保护与保存[J].中国实用妇科与产科杂志,2022,38(6):577-579.
[18] Matsuo K,Machida H,Grubbs BH,et al.Trends of low-grade serous ovarian carcinoma in the United States[J].J Gynecol Oncol,2018,29(1):e15.
[19] Sieh W,K?bel M,Longacre TA,et al.Hormone-receptor expression and ovarian cancer survival:an ovarian tumor tissue analysis consortium study[J].Lancet Oncol,2013,14(9):853-862.
[20] Gershenson DM,Bodurka DC,Lu KH,et al.Impact of age and primary disease site on outcome in women with low-grade serous carcinoma of the ovary or peritoneum:results of a large single-institution registry of a rare tumor[J].J Clin Oncol,2015,33(24):2675-2682.
[21] Jiang X,Yang J,Yu M,et al.Oncofertility in patients with stage I epithelial ovarian cancer:fertility-sparing surgery in young women of reproductive age[J].World J Surg Oncol,2017,15(1):154.
[22] Duska LR,Chang YC,Flynn CE,et al.Epithelial ovarian carcinoma in the reproductive age group[J].Cancer,1999,85(12):2623-2629.
[23] Kajiyama H,Shibata K,Suzuki S,et al.Is there any possibility of fertility-sparing surgery in patients with clear-cell carcinoma of the ovary?[J].Gynecol Oncol,2008,111(3):523-526.
[24] De Nonneville A,Zemmour C,Frank S,et al.Clinicopathological characterization of a real-world multicenter cohort of endometrioid ovarian carcinoma:Analysis of the French national ESME-Unicancer database[J].Gynecol Oncol,2021,163(1):64-71.
[25] K?bel M,Kalloger SE,Huntsman DG,et al.Differences in tumor type in low-stage versus high-stage ovarian carcinomas[J].Int J Gynecol Pathol,2010,29(3):203-211.
[26] Kajiyama H,Mizuno M,Shibata K,et al.Recurrence-predicting prognostic factors for patients with early-stage epithelial ovarian cancer undergoing fertility-sparing surgery:a multi-institutional study[J].Eur J Obstet Gynecol Reprod Biol,2014,175:97-102.
[27] Gouy S,Saidani M,Maulard A,et al.Results of fertility-sparing surgery for expansile and infiltrative mucinous ovarian cancers[J].Oncologist,2018,23(3):324-327.
[28] Shimada M,Kigawa J,Ohishi Y,et al.Clinicopathological characteristics of mucinous adenocarcinoma of the ovary[J].Gynecol Oncol,2009,113(3):331-334.
[29] 韩丽萍,刘丽雅.卵巢非上皮性恶性肿瘤生育力保护[J].中国实用妇科与产科杂志,2019,35(6):626-631.
[30] Morrison A,Nasioudis D.Reproductive outcomes following fertility-sparing surgery for malignant ovarian germ cell tumors:asystematic review of the literature[J].Gynecol Oncol,2020,158(2):476-483.
[31] Boran N,Tulunay G,Caliskan E,et al.Pregnancy outcomes and menstrual function after fertility sparing surgery for pure ovarian dysgerminomas[J].Arch Gynecol Obstet,2005,271(2):104-108.
[32] Park JY,Kim DY,Suh DS,et al.Analysis of outcomes and prognostic factors after fertility-sparing surgery in malignant ovarian germ cell tumors[J].Gynecol Oncol,2017,145(3):513-518.
[33] Ray-Coquard I,Brown J,Harter P,et al.Gynecologic Cancer InterGroup(GCIG) consensus review for ovarian sex cord stromal tumors[J].Int J Gynecol Cancer,2014,24(9 Suppl 3):S42-S47.
[34] Gouy S,Arfi A,Maulard A,et al.Results from a monocentric long-term analysis of 23 patients with ovarian Sertoli-Leydig cell tumors[J].Oncologist,2019,24(5):702-709.
[35] Schneider DT,Orbach D,Cecchetto G,et al.Ovarian Sertoli Leydig cell tumours in children and adolescents:an analysis of the European Cooperative Study Group on Pediatric Rare Tumors(EXPeRT)[J].Eur J Cancer,2015,51(4):543-550.
[36] 袁增,宋坤,孔北华.遗传性卵巢癌预防性附件切除术的相关问题与争议[J].中国实用妇科与产科杂志,2021,37(6):623-627.
[37] Griffiths MJ,Winship AL,Hutt KJ.Do cancer therapies damage the uterus and compromise fertility?[J].Hum Reprod Update,2020,26(2):161-173.
[38] Oktay K,Harvey BE,Partridge AH,et al.Fertility preservation in patients with cancer:ASCO clinical practice guideline update[J].J Clin Oncol,2018,36(19):1994-2001.
[39] Lambertini M,Peccatori FA,Demeestere I,et al.Fertility preservation and post-treatment pregnancies in post-pubertal cancer patients:ESMO Clinical Practice Guidelines[J].Ann Oncol,2020,31(12):1664-1678.
[40] 中华医学会生殖医学分会.生育力保存中国专家共识[J].生殖医学杂志,2021,30(9):1129-1134.
[41] Wilson MK,Fong P,Mesnage S,et al.Stage I granulosa cell tumours:a management conundrum? Results of long-term follow-up[J].Gynecol Oncol,2015,138(2):285-291.
[42] Ma N,Chen G,Chen J,et al.Transient impact of paclitaxel on mouse fertility and protective effect of gonadotropin?releasing hormone agonist[J].Oncol Rep,2020 ,44(5):1917-1928.
[43] Fornier MN,Modi S,Panageas KS,et al.Incidence of chemotherapy-induced,long-term amenorrhea in patients with breast carcinoma age 40 years and younger after adjuvant anthracycline and taxane[J].Cancer,2005,104(8):1575-1579.
[44] Tarumi W,Suzuki N,Takahashi N,et al.Ovarian toxicity of paclitaxel and effect on fertility in the rat[J].J Obstet Gynaecol Res,2009,35(3):414-420.
[45] Anderson RA,Themmen AP,Al-Qahtani A,et al.The effects of chemotherapy and long-term gonadotrophin suppression on the ovarian reserve in premenopausal women with breast cancer[J].Hum Reprod,2006,21(10):2583-2592.
[46] Ntemou E,Vidal PD,Alexandri C,et al.Ovarian toxicity of carboplatin and paclitaxel in mouse carriers of mutation in BRIP1 tumor suppressor gene[J].Sci Rep,2022,12(1):1658.
[47] Nasioudis D,Mastroyannis SA,Albright BB,et al. Adjuvant chemotherapy for stage I ovarian clear cell carcinoma:patterns of use and outcomes[J].Gynecol Oncol,2018,150(1):14-18.
[48] Weinberg LE,Lurain JR,Singh DK,et al.Survival and reproductive outcomes in women treated for malignant ovarian germ cell tumors[J].Gynecol Oncol,2011,121(2):285-289.
[49] Gadducci A,Lanfredini N,Tana R.Menstrual function and childbearing potential after fertility-sparing surgery and platinum-based chemotherapy for malignant ovarian germ cell tumours[J].Gynecol Endocrinol,2014,30(7):467-471.
[50] Gaffan J,Holden L,Newlands ES,et al.Infertility rates following POMB/ACE chemotherapy for male and female germ cell tumours-a retrospective long-term follow-up study[J].Br J Cancer,2003,89(10):1849-1854.
[51] Blommaert FA,Michael C,van Dijk-Knijnenburg HC,et al.The formation and persistence of carboplatin-DNA adducts in rats[J].Cancer Chemother Pharmacol,1996,38(3):273-280.
[52] Higdon RE,Marchetti F,Mailhes JB,et al.The effects of cisplatin on murine metaphase Ⅱ oocytes[J].Gynecol Oncol,1992,47(3):348-352.
[53] Patterson P,McDonald FE,Zebrack B,et al.Emerging issues among adolescent and young adult cancer survivors[J].Semin Oncol Nurs,2015,31(1):53-59.
[54] Hohmann C,Borgmann-Staudt A,Rendtorff R,et al.Patient counselling on the risk of infertility and its impact on childhood cancer survivors:results from a national survey[J].J Psychosoc Oncol,2011,29(3):274-285.
[55] Su HC,Haunschild C,Chung K,et al.Prechemotherapy antimullerian hormone,age,and body size predict timing of return of ovarian function in young breast cancer patients[J].Cancer,2014,120(23):3691-3698.
[56] Silva C,Caramelo O,Almeida-Santos T,et al.Factors associated with ovarian function recovery after chemotherapy for breast cancer:a systematic review and meta-analysis[J].Hum Reprod,2016,31(12):2737-2749.
[57] Barnabei A,Strigari L,Marchetti P,et al.Predicting ovarian activity in women affected by early breast cancer:a meta-analysis-based nomogram[J].Oncologist,2015,20(10):1111-1118.
[58] Jones MR,Kamara D,Karlan BY,et al.Genetic epidemiology of ovarian cancer and prospects for polygenic risk prediction[J].Gynecol Oncol,2017,147(3):705-713.
[59] Alsop K,Fereday S,Meldrum C,et al.BRCA mutation frequency and patterns of treatment response in BRCA mutation-positive women with ovarian cancer:a report from the Australian Ovarian Cancer Study Group[J].J Clin Oncol,2012,30(21):2654-2663.
[60] Heravi-Moussavi A,Anglesio MS,Cheng SW,et al.Recurrent somatic DICER1 mutations in nonepithelial ovarian cancers[J].N Engl J Med,2012,366(3):234-242.
[61] Shah SP,Kobel M,Senz J,et al.Mutation of FOXL2 in granulosa-cell tumors of the ovary[J].N Engl J Med,2009,360(26):2719-2729.
[62] Van Nieuwenhuysen E,Lambrechts S,Lambrechts D,et al.Genetic changes in nonepithelial ovarian cancer[J].Expert Rev Anticancer Ther,2013,13(7):871-882.
[63] De Paolis E,Paragliola RM,Concolino P.Spectrum of DICER1 germline pathogenic variants in ovarian Sertoli-Leydig cell tumor[J].J Clin Med,2021,10(9):1845.
[64] Finch AP,Lubinski J,Moller P,et al.Impact of oophorectomy on cancer incidence and mortality in women with a BRCA1 or BRCA2 mutation[J].J Clin Oncol,2014,32:1547-1553.
[65] Daly MB,Pilarski R,Berry M,et al.NCCN Guidelines insights:genetic/familial high-risk assessment:breast and ovarian,version 2.2017[J].J Natl Compr Canc Netw,2017,15(1):9-20.
[66] Turan V,Lambertini M,Lee DY,et al.Association of germline BRCA pathogenic variants with diminished ovarian reserve:a meta-analysis of individual patient-level data[J].J Clin Oncol,2021,39(18):2016-2024.
[67] Lin W,Titus S,Moy F,et al.Ovarian aging in women with BRCA germline mutations[J].J Clin Endocrinol Metab,2017,102(10):3839-3847.
[68] Lambertini M,Goldrat O,Toss A,et al.Fertility and pregnancy issues in BRCA-mutated breast cancer patients[J].Cancer Treat Rev,2017,59:61-70.
[69] Turan V,Oktay K.BRCA-related ATM-mediated DNA double-strand break repair and ovarian aging[J].Hum Reprod Update,2020,26(1):43-57.
[70] ESHRE Guideline Group on Female Fertility Preservation,Anderson RA,Amant F,et al.ESHRE guideline:female fertility preservation[J].Hum Reprod Open,2020,2020(4):hoaa052.
[71] Gatta G,van der Zwan JM,Casali PG,et al.Rare cancers are not so rare:the rare cancer burden in Europe[J].Eur J Cancer,2011,47(17):2493-2511.
[72] 薛凤霞,滕飞,魏丽坤.妇科恶性肿瘤保留生育功能生育结局[J].中国实用妇科与产科杂志,2019,35(6):646-651.
[73] Canlorbe G,Chabbert-Buffet N,Uzan C.Fertility-sparing surgery for ovarian cancer[J].J Clin Med,2021,10(18):4235.
[74] Johansen G,Dahm-K?hler P,Staf C,et al.Fertility-sparing surgery for treatment of non-epithelial ovarian cancer:oncological and reproductive outcomes in a prospective nationwide population-based cohort study[J].Gynecol Oncol,2019,155(2):287-293.
[75] Yang B,Yu Y,Chen J,et al.Possibility of women treated with fertility-sparing surgery for non-epithelial ovarian tumors to safely and successfully become pregnant-a Chinese retrospective cohort study among 148 cases[J].Front Med,2018,12(5):509-517.
[76] Zanetta G,Bonazzi C,Cantù M,et al.Survival and reproductive function after treatment of malignant germ cell ovarian tumors[J].J Clin Oncol,2001,19(4):1015-1020.
[77] de La Motte RT,Pautier P,Duvillard P,et al.Survival and reproductive function of 52 women treated with surgery and bleomycin,etoposide,cisplatin(BEP) chemotherapy for ovarian yolk sac tumor[J].Ann Oncol,2008,19(8):1435-1441.
[78] Zhang N,Chen R,Hua K,et al.A retrospective study of reproductive outcomes after fertility-sparing surgery and postoperative adjuvant chemotherapy in malignant ovarian germ cell tumors and sex cord-stromal tumors[J].J Ovarian Res,2017,10(1):52.
[79] Tangir J,Zelterman D,Ma W,et al.Reproductive function after conservative surgery and chemotherapy for malignant germ cell tumors of the ovary[J].Obstet Gynecol,2003,101(2):251-257.
[80] Wang D,Cao D,Jia C,et al.Analysis of oncologic and reproductive outcomes after fertility-sparing surgery in apparent stage I adult ovarian granulosa cell tumors[J].Gynecol Oncol,2018,151(2):275-281.
[81] Wang D,Zhu S,Jia C,et al.Oncological and reproductive outcomes of cystectomy compared with unilateral salpingo-oophorectomy as fertility-sparing surgery in patients with apparent early stage pure immature ovarian teratomas[J].Ann Surg Oncol,2021,28(11):6684-6693.
