卵巢癌是世界上第三大常见的妇科恶性肿瘤之一,同时也是死亡率最高的妇科恶性肿瘤[1]。与卵巢癌预后相关的因素除了FIGO分期、手术后病灶的残留情况之外,组织病理学类型也是重要的因素[2-7]。组织学上,根据独特的形态病理学和分子遗传学特征,卵巢癌被分为I型和II型。I型多生长缓慢,在诊断时多为早期,主要为低级别浆液性癌、低级别卵巢子宫内膜样癌以及卵巢透明细胞癌、卵巢黏液性癌。相比之下,II型通常一经诊断已处于临床晚期,生长迅速,侵袭性强,预后差,主要包括高级别卵巢浆液性癌、卵巢子宫内膜样癌,以及卵巢未分化癌、癌肉瘤等[8-9]。
原发性黏液性卵巢癌(MOC)被归类为I型肿瘤,它被认为是一种非侵袭性的组织学亚型。以往一些研究认为,原发性黏液性癌占上皮性卵巢癌的10%~15%。然而,这一数据随着近年来病理认识的更新,尤其是一些病理的回顾性分析发现,既往认为是原发性黏液性癌中有50%~70%实际上是从其他部位转移的。而卵巢上皮性癌是黏液性卵巢癌的真实比例接近1%~3%[10-11],可以说,MOC是一种罕见的肿瘤。

作者:王雅卓
单位:河北省人民医院
一、原发性MOC的浸润模式分型
以往几十年来,根据MOC的核异型性和实体腺成分的比例,MOC被进一步划分为1级、2级和3级,这种分级类似浆液性癌的高级别、低级别的分级模式,然而,在2014年,世界卫生组织(WHO)引入了一种新的MOC诊断分类,根据生长模式将其分为两种亚型,即膨胀性亚型(expansile invasion)和浸润性亚型(infiltrative invasion)[12]。膨胀性亚型较多见,镜下表现为密集分布的互相融合或复杂的恶性腺体(“背靠背”现象),腺体之间几乎没有间质分隔。预后好;而浸润性亚型相对少见,以腺体、细胞簇或单细胞形式破坏侵犯间质,较膨胀性亚型具有更强的侵袭性,预后差[13-15](图1)。
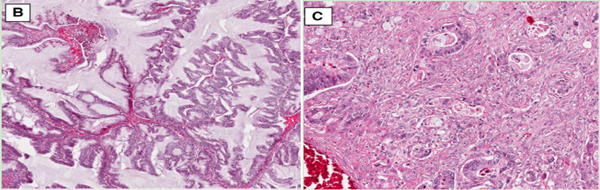
图1. MOC膨胀性亚型(左图)、浸润性亚型(右图)。
二、原发性MOC的浸润模式与预后的关系
膨胀性和浸润性MOC有着截然不同的预后,因此,明确两种病理类型的区别对指导MOC患者的手术方式和范围、后续辅助治疗具有非常重要的临床意义。浸润性MOC更具侵袭性,至少26%的患者诊断时期别较晚,并且有其他部位的转移,即使是在I期的患者中也有17%~30%的患者检测到淋巴结转移。即使诊断为早期,也有15%~30%的I期患者会出现疾病的复发。而膨胀性MOC恰恰相反,它具有较低的转移潜力,超过95%的该型患者肿瘤分期为Ⅰ期,且复发风险极低[16-21]。
Hada等[22]进行了一项回顾性研究,共纳入了83例MOC患者(其中25例为膨胀性亚型)、85例交界性黏液性肿瘤。结果发现,膨胀性MOC与交界性黏液性肿瘤患者有着相似的生存结局(图2)。另一项研究共纳入浸润性MOC患者25例和膨胀性MOC患者24例。结果发现,浸润性MOC患者的无进展生存期和总生存期更差,差异具有统计学意义(P<0.01)。该研究表明,浸润性亚型的浸润模式与FIGO分期、手术后残留情况均是MOC患者预后差的独立危险因素[23]。鉴于两种浸润模式的预后不同,因此,正确判断膨胀性和浸润性亚型至关重要,因为它可能决定患者手术方式的选择以及后续的治疗决策。
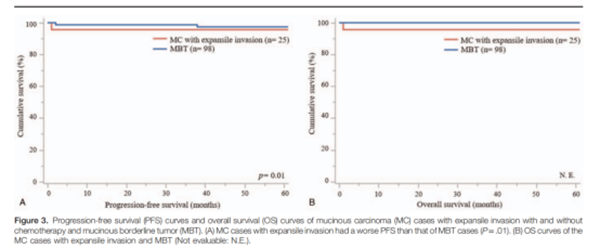
图2. 对比膨胀性MOC与交界性黏液性肿瘤患者的PFS(左图)和总生存期(右图)。
三、MOC患者两种浸润模式下的治疗决策
1、手术治疗
1.1 早期原发性MOC患者的手术治疗
临床上FIGO I期的MOC患者最为常见,根据目前NCCN指南及国内专家共识的推荐,手术原则是可进行保留生育能力手术(fertility sparing surgery,FSS)或全面分期手术,IA-IB期患者术后可观察,IC期患者术后可选择观察或辅助化疗[24]。已有很多的研究证实,对于有生育要求的FIGO早期MOC患者,实施保留生育功能的分期手术与全面分期手术,患者预后及复发率均无统计学差异,证实了早期MOC患者行保留生育功能手术的安全性[25-27]。
一项回顾性研究对比了不同浸润模式下MOC患者行保留生育功能手术的术后生存结局,结果证实无论是膨胀性亚型还是浸润性亚型,对于IA期和IC1-2期MOC患者行保留生育功能的手术均是可行的,两者复发率也并未看到显著差异[28]。
原发性MOC患者是否需要术中同时切除阑尾,目前尚存争议,有研究认为,术中探查外观正常的阑尾,其术后病理检查为阳性的可能性非常低,属于罕见事件,因此并不主张术中同时切除阑尾[29-30]。也有学者认为,即便外观正常的阑尾,也应术中同时行手术切除。但对于两种不同的浸润模式,并没有研究对阑尾转移率进行对比,因此无法做出相应的论证[31]。
关于原发性MOC患者是否需要切除淋巴结,以往的研究表明,在MOC患者中,FIGO I期患者的淋巴结转移率非常低[32-33]。因此,有一些学者建议在MOC患者的分期手术中可以不做淋巴结切除术[32]。然而,Muyldermans等最近的一项研究发现,在10例接受淋巴结取样的浸润性MOC病例中,有4例出现淋巴结转移[34]。该研究首次专门分析了两种MOC不同浸润模式下的淋巴结转移情况。
另一项研究,Gouy等发现,在31例接受淋巴结切除术(包括盆腔和主动脉旁淋巴结切除术)的MOC患者中,浸润性的23例患者中有4例(17%)淋巴结为阳性。而膨胀性患者中没有发现一例有淋巴结转移[35]。因此,建议所有浸润性MOC患者进行盆腔和主动脉旁淋巴结切除术,无论分期如何,但对于I期膨胀性MOC患者,可以安全地省略。
但是在理想情况下,我们是否可以使用术中快速冰冻来明确两种浸润亚型并进一步决定术中是否同时实施淋巴结切除术?事实上,由于通常情况下MOC患者的肿瘤体积庞大(有时直径>25 cm),并且混合不同的组织学成分,故利用术中快速冰冻病理检查来确定MOC到底属于膨胀性还是浸润性,这是非常具有挑战性的。我们期待更多的相关研究,来解决这一难题。
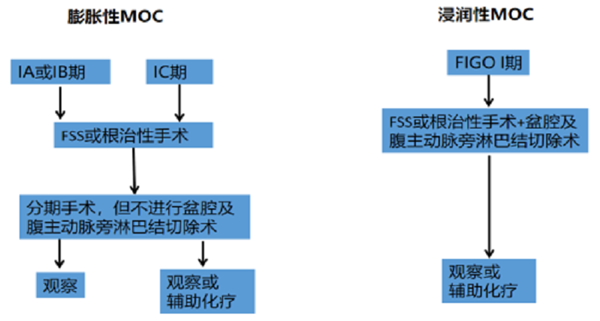
图3. FIGO I 期MOC两种亚型患者的临床处理流程。
1.2 晚期原发性MOC患者的手术治疗
虽然临床上FIGO I期的MOC患者最为常见,且预后好,但是FIGO III期或IV期MOC患者的预后比其他常见亚型(特别是卵巢浆液性或子宫内膜样卵巢癌)更差,这可能与其固有的侵袭性生物学和较差的化疗反应有关[36-38]。在一项纳入3126例患者(其中147例MOC)的随机试验分析中,对MOC患者数据的多变量分析显示,残留病变的大小是影响总体生存期和无进展生存期的独立因素[39]。因此,无论是膨胀性还是浸润性亚型,尽可能地做到手术的完全切除仍然是晚期MOC患者治疗的基石。
2、非手术治疗
与其他卵巢上皮性癌亚型相比,MOC患者已被证明对以铂类为基础的化疗存在一定的耐药性,反应较差。目前一些研究结果显示,MOC患者对化疗的应答率在12%~35%之间,而卵巢高级别浆液性癌患者的应答率为70%[40]。近些年,靶向治疗是MOC患者的研究热点,与浆液性卵巢癌不同,MOC与BRCA基因突变或同源重组缺陷无关,使它们不太可能从PARP抑制剂中获益[41]。国内的专家共识根据现有的研究证据,建议VEGF抑制剂可用于MOC患者的治疗。KRAS野生型MOC患者可尝试西妥昔单抗治疗,HER2阳性MOC患者可尝试曲妥珠单抗治疗,但是证据等级均较低[24]。我们期待今后大规模的前瞻性随机对照研究对MOC患者的非手术治疗提供新的思路,在治疗上带来突破。
四、总结与展望
MOC是上皮性卵巢癌中的一种特殊亚型,发病率极低。高达80%的MOC患者诊断时为早期,预后良好。然而,晚期疾病患者与HGSC相比,其预后要差得多。对于早期MOC患者,手术管理在某些方面仍存在一定的不确定性。目前研究结果提示,在膨胀性MOC患者中,常规的盆腔和主动脉旁淋巴结切除术可以安全地省略,但浸润性MOC患者仍应进行。是否应进行阑尾切除术目前尚无定论。在晚期疾病患者中,满意的肿瘤细胞减灭术仍是影响预后的最关键因素。
在临床工作中,病理学家诊断MOC仍然具有挑战性,除了要准确识别原发性和转移性黏液性癌之外,如何利用术中冰冻病理检查来进一步区分两种浸润模式,从而决定术中是否要同时行淋巴结切除仍是一大挑战。此外,虽然已知MOC患者对化疗耐药或对标准化疗方案反应很差,但目前并没有更好的化疗方案可以选择。到目前为止,还没有成功的专门针对MOC患者的前瞻性II期或III期随机临床试验。GOG241研究未能实现目标就是一个明确的例子,说明这些罕见肿瘤患者要获得高水平数据是多么具有挑战性,在未来,我们可能需要国内外多中心合作,扩大样本量,开展大数据研究,为确定原发性MOC患者的治疗策略提供较高质量证据。
参考文献
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020 [J]. CA Cancer J Clin, 2020, 70(1): 7-30. doi: 10.3322/caac.21590.
[2] Kossa? M, Leary A, Scoazec JY, Genestie C. Ovarian cancer: a heterogeneous disease. Pathobiology. 2018; 85: 41-9.
[3] Pereira A, Pérez-Medina T, Magrina JF, et al. International Federation of Gynecology and Obstetrics staging classification for cancer of the ovary, fallopian tube, and peritoneum: estimation of survival in patients with node-positive epithelial ovarian cancer. Int J Gynecol Cancer. 2015; 25: 49-54.
[4] du Bois A, Reuss A, Pujade-Lauraine E, et al. Role of surgical outcome as prognostic factor in advanced epithelial ovarian cancer: a combined exploratory analysis of 3 prospectively randomizes phase 3 multicenter trials. Cancer. 2009; 115: 1234-44.
[5] Chi DS, Eisenhauer EL, Lang J, et al. What is the optimal goal of primary cytoreductive surgery for bulky stage IIIC epithelial ovarian carcinoma (EOC)? Gynecol Oncol. 2006; 103: 559-64.
[6] Terauchi F, Nishi H, Moritake T, et al. Prognostic factor on optimal debulking surgery by maximum effort for stage IIIC epithelial ovarian cancer. J Obstet Gynaecol Res. 2009; 35: 315-9.
[7] Chi DS, Eisenhauer EL, Zivanovic O, Sonoda Y, et al. Improved progression-free and overall survival in advanced ovarian cancer as a result of a change in surgical paradigm. Gynecol Oncol. 2009; 114: 26-31.
[8] Kurman RJ, Shih IeM. The origin and pathogenesis of epithelial ovarian cancer: a proposed unifying theory. Am J Surg Pathol. 2010; 34: 433-43.
[9] Kurman RJ, Shih Ie M. The dualistic model of ovarian carcinogenesis: revisited, revised, and expanded. Am J Pathol. 2016; 186: 733-47.
[10] Seidman JD, Horkayne-Szakaly I, Haiba M, , et al. The histologic type and stage distribution of ovarian carcinomas of surface epithelial origin. Int J Gynecol Pathol 2004; 23: 41-4.
[11] Heinzelmann-Schwarz VA, GardinerGarden M, Henshall SM, et al. A distinct molecular profile associated with mucinous epithelial ovarian cancer. Br J Cancer 2006; 94: 904-13.
[12] Kurman RJ, Carcangiu ML, Herrington CS, Young RH. WHO classification of tumours of female reproductive organs. 4th ed. IARC. Lyon, France: International Agency for Research on Cancer, 2014:10-40.
[13] Lee K R, Scully RE. Mucinous tumors of the ovary: a clinicopathologic study of 196 borderline tumors (of intestinal type) and carcinomas, including an evaluation of 11 cases with pseudomyxoma peritonei’. Am J Surg Pathol, 2000, 24 (11) : 1447-1464.
[14] Prat J, D' angelo E, Espinosa I. Ovarian carcinomas: at least five different diseases with distinct histological features and molecular genetics. Hum Pathol, 2018, 80: 11-27.
[15] Muyldermans K, Moerman P, Amant F, et al. Primary invasive mucinous ovarian carcinoma of the intestinal type: importance of the expansile versus infiltrative type in predicting recurrence and lymph node metastases. Eur J Cancer, 2013, 49(7) : 1600-1608.
[16] Lee KR, Scully RE. Mucinous tumors of the ovary: a clinicopathologic study of 196 borderline tumors (of intestinal type) and carcinomas, including an evaluation of 11 cases with ‘pseudomyxoma peritonei.’ Am J Surg Pathol 2000; 24: 1447-64.
[17] Riopel MA, Ronnett BM, Kurman RJ. Evaluation of diagnostic criteria and behavior of ovarian intestinal-type mucinous tumors: atypical proliferative (borderline) tumors and intraepithelial, microinvasive, invasive, and metastatic carcinomas. Am J Surg Pathol 1999; 23: 617-35.
[18] Rodríguez IM, Prat J. Mucinous tumors of the ovary: a clinicopathologic analysis of 75 borderline tumors (of intestinal type) and carcinomas. Am J Surg Pathol 2002; 26: 139-52.
[19] Muyldermans K, Moerman P, Amant F, et al. Primary invasive mucinous ovarian carcinoma of the intestinal type: importance of the expansile versus infiltrative type in predicting recurrence and lymph node metastases. Eur J Cancer 2013; 49: 1600-8.
[20] Gouy S, Saidani M, Maulard A, et al. Characteristics and prognosis of stage I ovarian mucinous tumors according to expansile or infiltrative type. Int J Gynecol Cancer 2018; 28: 493-9.
[21] Hoerl HD, Hart WR. Primary ovarian mucinous cystadenocarcinomas: a clinicopathologic study of 49 cases with long term follow-up. Am J Surg Pathol 1998; 22: 1449-62.
[22] Hada T, Miyamoto M, Ishibashi H et. Prognostic similarity between ovarian mucinous carcinoma with expansile invasion and ovarian mucinous borderline tumor: A retrospective analysis. Medicine (Baltimore). 2021 Aug 13; 100 (32): e26895.
[23] Hada T, Miyamoto M, Ishibashi H, et al. Survival and biomarker analysis for ovarian mucinous carcinoma according to invasive patterns: retrospective analysis and review literature. J Ovarian Res. 2021 Feb 14; 14 (1): 33.
[24] 张德普, 孙阳, 张师前, 付凤仙, 马瑞卿, 卢一艳, 王刚, 孔为民, 李庆水, 王建六, 向阳, 罗成华. 黏液性卵巢癌诊断与治疗中国专家共识(2021年版)[J]. 中国微创外科志, 2021, 21 (07): 577-588.
[25] Bentivegna E, Fruscio R, Roussin S, et al. Long-term follow-up of patients with an isolated ovarian recurrence after conservative treatment of epithelial ovarian cancer: review of the results of an international multicenter study comprising 545 patients. Fertil Steril, 2015, 104( 5) : 1319 -1324.
[26] Lee JY, Jo Y R, Kim TH, et al. Safety of fertility-sparing surgery in primary mucinous carcinoma of the ovary. Cancer Res Treat, 2015, 586· Chin J Min Inv Surg, July 2021, Vol.. 21. No. 747( 2) : 290-297.
[27] Kajiyama H, Shibata K, Mizuno M, et al. Fertility-sparing surgery in young women with mucinous adenocarcinoma of the ovary. Gynecol Oncol, 2011, 122(2) : 334-338.
[28] Gouy S, Saidani M, Maulard A, et al. Results of fertility-sparing surgery for expansile and infiltrative mucinous ovarian cancers. Oncologist, 2018, 23( 3) : 324-327.
[29] Lin JE, Seo S, Kushner DM, et al. The role of appendectomy for mucinous ovarian neoplasms. Am J Obstet Gynecol, 2013, 208(1) :46. e41-e44.
[30] Cheng A, Li M, Kanis MJ, et al. Is it necessary to perform routine appendectomy for mucinous ovarian neoplasms? A retrospective study and meta-analysis. Gynecol Oncol, 2017, 144(1): 215-222.
[31] Rosendahl M, Haueberg Oester LA, H gdall CK. The importance of appendectomy in surgery for mucinous adenocarcinoma of the ovary. Int J Gynecol Cancer, 2017, 27(3): 430-436.
[32] Morice, P., Joulie, F., Camatte, S., et al., 2003. Lymph node involvement in epithelial ovarian cancer: analysis of 276 pelvic and paraaortic lymphadenectomies and surgical implications. J. Am. Coll. Surg. 197, 198-205.
[33] Powless, C.A., Bakkum-Gamez, J.N., Aletti, G.D., Cliby, W.A., 2009. Random peritoneal biopsies have limited value in staging of apparent early stage epithelial ovarian cancer after thorough exploration. Gynecol. Oncol. 115, 86-89.
[34] Muyldermans, K., Moerman, P., Amant, F., et al. 2013 Primary invasive mucinous ovarian carcinoma of the intestinal type: importance of the expansile versus infiltrative type in predicting recurrence and lymph node metastases. Eur. J. Cancer 49, 1600-1608.
[35] Gouy S, Saidani M, Maulard A, et al. Staging surgery in early-stage ovarian mucinous tumors according to expansile and infiltrative types. Gynecol Oncol Rep. 2017 Sep 1; 22: 21-25.
[36] Alexandre J, Ray-Coquard I, Selle F, et al. Mucinous advanced epithelial ovarian carcinoma: clinical presentation and sensitivity to platinum-paclitaxel-based chemotherapy, the GINECO experience. Ann Oncol 2010; 21: 2377-81.
[37] Karabuk E, Kose MF, Hizli D, et al. Comparison of advanced stage mucinous epithelial ovarian cancer and serous epithelial ovarian cancer with regard to chemosensitivity and survival outcome: a matched case-control study. J Gynecol Oncol 2013; 24: 160-6.
[38] Pisano C, Greggi S, Tambaro R, et al. Activity of chemotherapy in mucinous epithelial ovarian cancer: a retrospective study. Anticancer Res 2005; 25: 3501-5.
[39] du Bois A, Reuss A, Pujade-Lauraine E, et al. Role of surgical outcome as prognostic factor in advanced epithelial ovarian cancer: a combined exploratory analysis of 3 prospectively randomized phase 3 multicenter trials: by the Arbeitsgemeinschaft Gynaekologische Onkologie Studiengruppe Ovarialkarzinom (AGO-OVAR) and the Groupe d’Investigateurs Nationaux Pour les Etudes des Cancers de l’Ovaire (GINECO). Cancer 2009; 115: 1234-44.
[40] Nasioudis, D.; Haggerty, A.F.; Giuntoli, R.L.; et al. Adjuvant chemotherapy is not associated with a survival benefit for patients with early stage mucinous ovarian carcinoma. Gynecol. Oncol. 2019, 154, 302-307.
[41] Gorringe KL, Cheasley D, Wakefield MJ, et al. Therapeutic options for mucinous ovarian carcinoma. Gynecol Oncol, 2020, 156 (3): 552-560.
作者简介

王雅卓 主治医师
王雅卓,博士,主治医师,河北省人民医院妇科工作。
社会职务:河北省妇幼保健协会妇女健康管理专业委员会委员、河北省疼痛医学会妇科专业委员会委员、
河北省优生优育协会阴道镜和宫颈病理学专业委员会委员。
专业特长:熟练掌握妇科常见病及多发病的诊治,擅长宫颈病变诊治和妇科良恶性肿瘤的治疗,主要从事妇科恶性肿瘤的基础与临床研究。
科研成果及获奖情况:参与省级科研课题3项,发表论文及著作十余篇;获得“思辨卓行”辩论赛全国二等奖、河北医科大学英文授课竞赛二等奖、河北省人民医院科普大赛二等奖、河北省人民医院授课竞赛二等奖。
声明:本文为作者原创投稿并授权发布,文章仅代表作者观点,不代表本平台立场。如需转载请留言获取授权,未经授权谢绝转载。
