欧洲妇科肿瘤学会 (ESGO)、国际妇产科超声学会 (ISUOG)、国际卵巢肿瘤分析小组(IOTA) 和欧洲妇科内窥镜学会 (ESGE) 基于临床循证医学共同制订卵巢肿瘤术前诊断共识,包括影像技术、生物标志物和预测模型。ESGO/ISUOG/IOTA/ESGE提名多学科国际小组,包括在卵巢肿瘤的术前诊断和卵巢癌的管理方面有杰出领导力和专业知识的临床医生、研究人员(全欧洲19位专家)和一名患者代表。对当前文献进行评阅和评估,确保共识遵循循证医学。查阅相关文献起草初步共识。在电话会议上,所有成员讨论初步共识的每条声明,并进行第一轮投票。删除小组成员未达成共识的声明。投票者可以投票时评论或建议,相应地修订声明。小组内所有成员根据相同的规则进行另一轮投票评估修订版共识。小组就18项声明达成共识。 本文关于卵巢肿瘤术前诊断和癌肿评估的ESGO/ISUOG/IOTA/ESGE共识,以及每条声明的支持证据。
附件病变的特征对于确定适当的治疗方式至关重要。根据ESGO 的定义和建议指南,为获得专科护理,疑似恶性肿瘤的患者应转诊至妇科肿瘤中心。对于非妇科原发肿瘤,患者需转诊至合适的专科医生,而良性病变的患者根据具体的临床情况进行随访及保守治疗,或可能适合小型手术。根据患者的整体临床情况、症状、偏好、既往史和手术史、肿瘤标志物以及临床放射学的结果制订治疗方案。不应该使用单一的诊断模式决定患者的治疗方案。
ESGO、ISUOG、IOTA和ESGE共同制订关于卵巢肿瘤的术前诊断和疾病评估的共识,包括影像技术、生物标志物和预测模型。共识遵循循证医学。本共识不包括筛查和随访,以及成像技术、生物标志物和预测模型的经济分析。
基于现有文献和证据,一系列声明构成目前认可的卵巢肿瘤术前诊断和疾病评估方法的共识。任何应用或查阅这些声明的临床医生都应结合具体临床情况进行独立的医学判断确定患者的治疗和护理。本共识不对其内容、使用或应用作任何保证,作者不对其以任何方式的应用或使用承担任何责任。
通过八个步骤制订关于卵巢肿瘤术前诊断和疾病评估的共识。由Christina Fotopoulo和Dirk Timmerman教授主持(表1)。为组建多学科国际小组,ESGO/ISUOG/IOTA/ESGE提名19 名在卵巢肿瘤的术前诊断和卵巢癌患者的管理方面有杰出领导力和专业知识的临床医生、研究人员,他们有行政职责,和/或是委员会成员(包括八名ESGO 成员、五名 ISUOG 成员、四名 IOTA 成员和两名 ESGE 成员)。专家组包括七名擅长超声检查的妇科医生、两名放射科医生和10名妇科肿瘤学家。他们不代表所在组织,根据自身经验和专业知识做出决定。小组包括一名患者代表,是欧洲妇科癌症倡导组织 (ENGAGE) 临床试验项目的主席。小组内所有成员参与初步电话会议,以促进了解并讨论本共识的目的和范围。
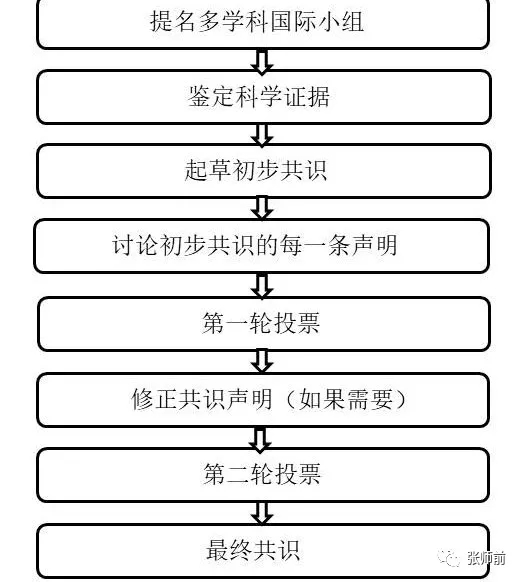
图1 制定关于卵巢肿瘤术前诊断和疾病发展评估共识的八步过程
对当前文献进行评阅和批判性评估以确保共识遵循循证医学。使用 MEDLINE 数据库(在线补充附录 1)对 2015 年 5 月 1 日至 2020 年 5 月 1 日期间发表的相关研究进行了系统的文献回顾。文献检索仅限于英文出版物。优先考虑高质量的系统综述、荟萃分析和验证的队列研究,也评估低证据等级的研究。检索时排除社论、快报和病例报告。审查纳入的每篇文章的参考文献以检索潜在相关文章。文献检索的最终结果发给所有小组成员,包括每篇文章的电子全文版本。其中一位作者 (FP) 提供整个过程的方法论和医学写作支持,并没有参与投票。
主席负责查阅相关文献起草初版。在第二次电话会议之前将其发送至多学科国际小组。在第二次电话会议期间,所有成员讨论每条初步声明,并对每一条进行第一轮二元投票(同意/不同意)。20名参与者参加所有投票。如果没有足够的专业知识同意/不同意该声明,或者存在可能影响投票的利益冲突,则允许弃权。如果小组成员之间没有达成共识,则删除该声明。投票者可以在投票时提出意见/建议。主席随后讨论第一轮投票的结果,并在必要时修改声明。投票结果和修改版共识再次发送至全组,以相同规则组织另一轮二元投票,所有成员评估修改版共识。在第二轮投票的结果上最终确定此共识。小组成员就18项声明达成了共识。本共识提供了支持证据、最终声明系列及其证据等级的摘要。
总论
在排除交界性卵巢肿瘤和非妇科原发性肿瘤(例如胃肠道或乳腺肿瘤)后,生化或放射检验的能力似乎有提高。但是为更好地反映临床现实,仍将所有类型的附件肿瘤纳入文献评估研究。
超声
在临床实践中,通常认为经阴道超声是评估附件病变的一线影像学检查。超声检查鉴别良恶性附件肿块的诊断准确性与医生的专业能力有关。欧洲医学和生物学超声学会联合发布了欧洲妇科超声从业的最低培训要求,包括理论知识标准和实践技能标准。将专业能力与训练分为三级。 III 级(专家级)是大部分时间从事妇科超声和/或该领域的教学、研究和开发的医生。II 级的医生应至少操作2000次妇科超声检查。通常在超声专科培训期间或培训完成后达到II级水平。为保持二级的能力,医生每年应至少操作500次超声检查。一级医生应在二级医生或至少有 2 年的常规操作经验的I级医生的监督下进行至少300 次超声检查。为保持I级水平,医生每年应至少操作300 次超声检查。一项评估妇科超声检查质量对疑似卵巢癌患者管理效果的前瞻性随机对照试验表明, III 级(专家级)超声检查的患者比II级(常规级)超声检查者不必要的主要手术明显减少,住院时间更短。
超声专家的主观评估在鉴别卵巢肿瘤良恶性方面具有出色的表现。在许多情况下,超声专家能够将诊断范围进一步缩小至特定的组织学亚型。一些关键组织学类型的典型病理超声特征已发表在妇产科超声的“妇科影像学”系列中。
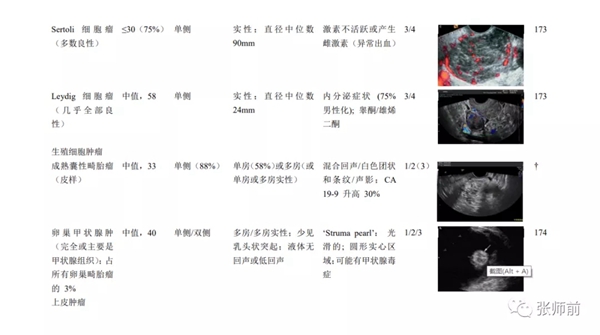
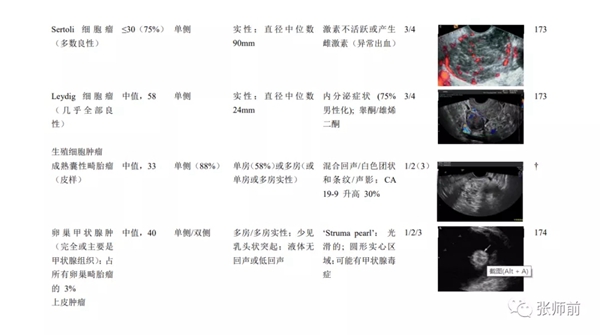
表1 每种病理的常见和典型的表现









恶性肿瘤风险指数 (RMI)和卵巢恶性肿瘤风险算法(ROMA)
为寻找更客观的鉴别良恶性附件肿瘤的超声诊断方法,学者已进行了少量尝试。包括RMI、基于绝经状态的评分系统、经阴道超声评分和血清CA 125)水平。许多研究已证明RMI 在附件肿块分类中的作用。与原始版本(RMI-I)相比,RMI 的三种亚型(RMI-II、RMI-III、RMI-IV)无明显诊断诊断优势。Moore等基于CA 125和HE4提出一种新的评分系统——ROMA。Westwood等汇总比较 ROMA 和 RMI-I 的数据以指导疑似卵巢癌,并发现如果分析时排除患有交界性肿瘤和非上皮癌的女性,则二者结果相似。最近,另一项荟萃分析显示,RMI-I 在绝经前妇女中的特异性高于ROMA,但在检测出现附件肿块的绝经后妇女的卵巢癌中表现相似。RMI 的局限性在于没有对恶性肿瘤风险的估计及其对血清CA 125的高度依赖,后者导致对早期侵袭性和交界性疾病的敏感性相对较低,尤其是在绝经前妇女中(见肿瘤标志物)。
IOTA
为了统一和标准化不同中心超声检查的质量、描述和评估,提高诊断准确性,IOTA于 2000 年首次发表描述附件病变的术语和定义的共识。使用这种标准化方法,IOTA基于逻辑回归分析建立了不同预测模型。在大型外部验证研究中,Van Holsbeke等 发现IOTA 逻辑回归模型 1(LR1,具有12个变量)和模型2(LR2,具有6个变量)的表现优于其他12个模型,包括RMI。LR2比LR1更易于使用。Sayasneh等发现即使是经验不足的超声医师也能够使用IOTA LR1模型准确鉴别良性和恶性卵巢肿块,证明了IOTA模型的标准化和可重复性。IOTA制定了“Simple Rules”,可根据是否存在5个良性和5个恶性超声特征来鉴别肿块。这些规则可以适用于约80% 的附件肿块,其余被归类为不确定性。现已被广泛接受并应用于临床。最近,基于原始Simple Rules的超声特征建立了逻辑回归模型——Simple Rules风险模型。该模型能够个性化评估任何类型病变的恶性肿瘤风险。
表2 卵巢肿瘤术前诊断的主要模型和评分系统
图片
图片
由于可以相对容易地识别出许多卵巢肿块,IOTA提出4种常见良性病变典型特征和2种恶性病变特征的“Simple Descriptors”,可以给出“即时诊断”并反映出图像识别是超声检查的关键部分。这适用于约43%的附件肿块。顺序使用SimpleDescriptors、Simple Rules和专家主观评估构成的三步法在鉴别附件病变良恶性中具有很高的准确性。一项系统综述和荟萃分析提出IOTA Simple Rules和IOTA LR2 模型比包括RMI在内的其他评分系统效果更好。除证实这些发现外,另一项荟萃分析强调两步法,即采用 IOTA Simple Rules作为第一步,专家对不确定肿瘤进行主观评估作为第二步,并与超声专科医生的测试表现相匹配。IOTA Simple Rules已被纳入多个国家评估和管理附件肿块临床指南。作为首个评估附件肿块的国际共识,IOTA Simple Rules成为主要的诊断策略。
一项随机对照试验表明,在手术率和肿瘤安全决策过程的评估中,IOTA Simple Rules比RCOG制订的RMI改良版手术率更低。IOTA Simple Rules未导致更多癌症诊断延迟。结果发现,在使用 IOTA SimpleRules时添加血清CA 125和HE4等生物标志物,无论有无超声专家进行主观评估,都不会提高卵巢肿块特征的诊断,但成本高于顺序使用 IOTA Simple Descriptors、Simple Rules和专家评估的三步法。
IOTA建立了ADNEX模型。此多类预测模型是首个鉴别良性和恶性肿瘤的风险模型,将任何恶性肿瘤分为交界性肿瘤、I 期和 II-IV 期原发性癌和继发转移性肿瘤。经验丰富的超声医生收集参数建立并验证IOTAADNEX模型。
几项外部验证试验表明ADNEX模型在区分不同类型的卵巢肿瘤中作用突出,具有比RMI更高的临床价值。一项旨在验证II级医生能否应用ADNEX模型的研究证实,经验不足的医生也可以成功使用该模型。一项17个中心参与共4905个肿块的大型多中心队列研究比较六种不同的预测模型(RMI、LR2、Simple Rules、Simple Rules风险模型、ADNEX(有CA 125)模型和ADNEX(无CA 125),表明IOTA ADNEX模型和 IOTA Simple Rules风险模型是鉴别附件病变的卵巢肿块患者的最佳模型。
妇科影像报告和数据系统 (GI-RADS)
GI-RADS由Amor等于2009年首次引入,并在2年后由同一团队进行了多中心前瞻性验证。该报告系统将恶性肿瘤风险量化为五类:GI-RADS 1,绝对良性(估计恶性肿瘤概率 (EPM) 0%); GI-RADS 2,很可能良性(EPM <1%); GI-RADS 3,可能良性(EPM 1-4%);GI-RADS 4,可能恶性(EPM 5–20%); GI-RADS 5,很可能恶性(EPM >20%)。最近,几项研究证明GI-RADS系统在评估适合手术干预的女性的恶性附件肿块方面的价值。此外,与单独使用CA125 相比,联合使用GI-RADS和CA 125提高了对高风险恶性肿瘤的附件肿块的识别。
卵巢附件报告与数据系统 (O-RADS)
O-RADS超声术语于 2018 年发布,包括正常卵巢和各种附件病变的特征性超声表现,为附件病变描述和定义的标准化术语。O-RADS 超声工作组基于 O-RADS描述或IOTA ADNEX模型分出的卵巢肿瘤风险类别,建立了一个附件质量分类系统。但目前无论是分类系统还是O-RADS描述都没有经过外部验证。Basha等通过系统开发前收集的647个附件肿块组成的数据库验证了O-RADS方法的恶性率、有效性和可靠性。在这项回顾性研究中,O-RADS系统较GI-RADS系统和IOTA Simple Rules具有更高的敏感性,特异性无显著降低,并且具有相似的可靠性。
关于超声检查的声明(声明 1-6)
1. 超声专家级(III级)主观评估在鉴别良恶性卵巢肿瘤方面表现最佳。
——证据等级:1a
——声明等级:A
2. 如果没有专家级超声,使用超声诊断模型可以帮助临床医生鉴别良性和恶性卵巢肿瘤。
——证据等级:2a
——声明等级:B
——共识:同意,90%(n=18);不同意,0% (n=0);弃权,10% (n=2)
3. 超声诊断模型(IOTA Simple Rules风险模型或IOTA ADNEX 模型)优于CA 125 水平、HE4 水平或 ROMA,在鉴别良恶性卵巢肿瘤方面具有优势。
——证据等级:2b
——声明等级:B
——共识:同意,95%(n=19);不同意,0% (n=0);弃权,5% (n=1)
4. 推荐使用IOTA ADNEX模型和IOTA Simple Rules 风险模型,二者优于现有的形态学评分系统,包括 RMI。
——证据等级:1b
——声明等级:A
——共识:同意,95%(n=19);不同意,0% (n=0);弃权,5% (n=1)
5. IOTA ADNEX 模型是一个多类模型,有助于鉴别良性肿瘤、交界性肿瘤、早期或晚期卵巢癌和继发性转移性肿瘤。
——证据等级:3b
——声明等级:C
——共识:同意,85%(n=17);不同意,0% (n=0);弃权,15% (n=3)
6. 存在继发性转移性肿瘤的风险阈值(如IOTA ADNEX模型预测),高于该阈值应检测主要原发器官,为 10%。
——证据等级:5
——声明等级:D
——共识:5%阈值,10%(n=2);10%阈值,75% (n=15);15%阈值,0% (n=0); 20%阈值,0% (n=0);弃权,15% (n=3)
在线补充附录 2 描述了证据等级。
肿瘤标志物
根据CA 125水平在诊断良性、交界性和恶性卵巢肿瘤准确性的系统定量评价,CA 125 是迄今为止最佳可用的生物标志物。虽然CA125在疾病的早期阶段缺乏敏感性和特异性,并且总体特异性相对较低,但它可以指导可疑卵巢肿块患者的治疗。汇集分析强调,高体重指数和种族可能会影响CA 125 水平。影响CA 125水平的其他因素包括患者的年龄、妊娠、炎症以及肌瘤或子宫内膜异位症。
多项研究包括荟萃分析,都强调HE4对CA 125的潜在补充作用,尤其是在鉴别年轻女性的良性子宫内膜异位症和炎症性病变方面。与单独应用CA 125 相比,其他肿瘤标志(如 ROMA)未能显著提高良恶性肿块的鉴别。其他肿瘤标志物组合,包括将癌胚抗原 (CEA) 和CA 19-9与CA 125组合,主要用于鉴别胃肠道或胰腺的转移性肿瘤与原发性卵巢恶性肿瘤。
7. CA 125是术前判断卵巢肿瘤的最佳生物标志物。但不能用作卵巢癌的筛查试验。
——证据等级:2b
——声明等级:B
——共识:同意,95%(n=19);不同意,0% (n=0);弃权,5% (n=1)
8. 与单独应用CA 125 相比,HE4 和 ROMA 都不能提高良恶性肿块的鉴别。
——证据等级:2b
——声明等级:B
——共识:同意,70%(n=14);不同意,0% (n=0);弃权,30% (n=6)
9. CA 125不会提高超声风险模型鉴别良性和恶性肿瘤的能力。
——证据等级:2b
——声明等级:B
——共识:同意,60%(n=12);不同意,10% (n=2);弃权,30% (n=6)
10. CA 125 可作为疑似恶性肿瘤的生物标志物,有助于区分恶性肿瘤的亚型,例如交界性和早期、晚期原发性卵巢癌以及继发性转移性肿瘤。
——证据等级:2b
——声明等级:B
——共识:同意,90%(n=18); 不同意,5% (n=1);弃权,5% (n=1)
11. CEA 在特定情况下可能有助于鉴别原发性卵巢癌和继发性(卵巢)肿瘤。
——证据等级:3b
——声明等级:C
——共识:同意,90%(n=18);不同意,0% (n=0);弃权,10% (n=2)
12. CA 19-9 有助于区分卵巢继发性转移性肿瘤。
——证据等级:3b
——声明等级:C
——共识:同意,75%(n=15);不同意,5% (n=1);弃权,20% (n=4)
在线补充附录 2 中描述了证据等级。
磁共振成像/计算机断层扫描/正电子发射断层扫描-计算机断层扫描
磁共振成像
一些报告发现,单独使用MRI或与CT 结合可准确预测肿瘤细胞减灭术术前评估的患者是否存在腹膜癌,尤其是由有经验的放射学家进行评估。最近,一项前瞻性研究报告称,IOTA LR2 模型比经验丰富的放射科医生对 MRI 结果的主观解释具有更高的特异性,在鉴别肿瘤良恶性时两种方式具有相似灵敏度。多项汇集研究表明,将扩散加权技术添加到传统成像模式可提高肿瘤良恶性鉴别的准确性,有数据甚至表明其在预测可切除性中具有一定价值。其真实程度需要在多中心大规模前瞻性随机研究中进一步验证。联合定量动态对比增强 MRI 和弥散加权成像和T1 MRI序列以及O-RADS MRI评分是另一种现代诊断的手段,具有在超声无法明确诊断(即不确定的肿块)时鉴别良恶性附件肿块的良好前景。通过量化增强时,可以协助鉴别 I 型和Ⅱ型上皮性卵巢癌。关于 MRI技术对临床决策影响的数据有限,需要对更大样本人群进行进一步研究。
计算机断层扫描
标准化CT腹膜癌症指数(CT-PCI)是常规临床实践中评估肿瘤扩散程度和是否存在腹膜癌的最常见的诊断工具。一项用以术前CT-PCI预判无肉眼残留病灶肿瘤细胞减灭术的研究表明,其预测值较低。在回顾性分析中,术前CT成像在检测卵巢癌手术关键部位肿瘤受累方面具有高特异性,但敏感性较低。多项关于交叉验证 CT 扫描在预测不可切除疾病和不完全细胞减灭术中的准确性的实验表明,准确率大幅下降。因此,不应使用CT作为预测腹膜癌可切除性和排除手术患者的唯一工具;相反应考虑完整的临床背景,如患有大/多灶性实质内远处转移、急性血栓栓塞事件或影响预后的继发性转移性肿瘤的患者。
正电子发射断层扫描-计算机断层扫描
正电子发射断层扫描计算机断层扫描 (PET-CT) 可能有助于区分恶性与交界性或良性卵巢肿瘤,但由于透明细胞和黏液侵袭性亚型中氟脱氧葡萄糖摄取量较低,其诊断能力可能会受到某些肿瘤组织学的影响。PET-CT 还可以作为诊断淋巴结转移的附加技术,尤其是在腹腔外或在影响临床管理的关键区域特征不明确的病变(例如胸部病变)。PET-CT不能作为诊断卵巢癌腹膜扩散真实程度的附加诊断方式,特别是肠系膜和肠浆膜,也无法预测关键部位的可切除性,尤其是存在小灶病变时。PET-CT在鉴别交界性肿瘤与良性肿瘤方面的诊断价值较低,不应用于临床决策,尤其是在考虑保留生育能力的决策时。
关于 MRI、CT 和 PET/CT 的声明(声明 13-17)
13. 功能序列、动态对比增强和弥散加权MRI 不是一线工具,但可用作超声检查后进一步区分良性、恶性和临界肿块的二线工具。
——证据等级:2a
——声明等级:B
——共识:同意,100%(n=20);不同意,0% (n=0);弃权,0% (n=0)
14. 超声检查后,如果检测继发性转移性肿瘤的非卵巢起源,第二步可以使用PET-CT和全身弥散MRI。
——证据等级:4
——声明等级:C
——共识:同意,90%(n=18);不同意,0% (n=0);弃权,10% (n=2)
15. PET-CT 不能可靠地区分交界性肿瘤和良性肿瘤。
——证据等级:4
——声明等级:C
——共识:同意,95%(n=19);不同意,0% (n=0);弃权,5% (n=1)
16. 单独的影像学不能可靠地检测腹膜癌(尤其是小灶癌变)或肠系膜和肠浆膜受累的整个范围。
——证据等级:3b
——声明等级:B
——共识:同意,85%(n=17);不同意,5% (n=1);弃权,10% (n=2)
17. 预测腹膜肿瘤可切除性时,不应单独使用影像学进行手术决策。
——证据等级:3b
——声明等级:B
——共识:同意,80%(n=16);不同意,15% (n=3);弃权,5% (n=1)
在线补充附录 2 中描述了证据级别和等级。
游离循环 DNA和循环肿瘤细胞
游离循环DNA 和循环肿瘤细胞作为非侵入性生物标志物和非侵入性活检(有时称为“液体活检”)已参与多项研究。甲基化游离DNA有可能在确诊2年前检测出一定比例的卵巢癌。即使缺乏验证研究,也可能指导个体化治疗。新型收集管的使用,稳定血细胞(避免血清/血浆样品中的背景 DNA 污染),将促进液体活检分析的临床应用。在一项使用染色体不稳定性作为指标评估游离循环DNA对原发性卵巢癌的诊断潜力的前瞻性研究中,证实游离循环DNA具有提高附件肿块患者术前预测恶性肿瘤的特异性的潜力。尽管循环生物标志物在了解肿瘤转移和起源方面发挥着关键作用,并可全面动态观察治疗和疾病进展过程中肿瘤演变,但仍未被列为常规临床实践的一部分。
一项荟萃分析表明,游离DNA的定量分析在卵巢癌的诊断中敏感性并不令人满意,特异性尚可接受。最近一项关于卵巢癌诊断的荟萃分析中,游离DNA 似乎比 CA 125 略好,与 HE4 相似。不过游离 DNA 在卵巢癌患者中的诊断价值仍不清楚,应谨慎解释数据。强烈建议进行进一步的大规模前瞻性研究,以验证单独或与常规标志物结合使用循环游离 DNA 作为卵巢癌诊断生物标志物的潜在适用性,并探索可能影响卵巢癌诊断准确性的潜在影响因素。
关于循环游离 DNA 和肿瘤细胞的声明(声明 18)
18. 游离循环 DNA 和循环肿瘤细胞尚不能应用于鉴别良恶性卵巢肿块的常规临床实践中。
——证据等级:4
——声明等级:C
——共识:同意,85%(n=17);不同意,5% (n=1);弃权,10% (n=2)
在线补充附录 2 中描述了证据级别和等级。
总结
专家就描述推荐步骤流程图达成了共识,以区分良性和恶性肿瘤(图 2)并指导患者合理治疗。建议将超声检查作为有提示附件肿块症状的患者和在影像学上偶然发现附件肿块的患者分层的第一步。如果检查排除了正常的卵巢和生理变化(即排除了O-RADS 1),下一步可以应用 IOTA ADNEX 模型确定恶性肿瘤的风险。存在可疑卵巢肿块时,任何超声检查都应由专业超声医师进行。采用O-RADS对结果分类,进一步指导患者的转诊和管理。
专家还就在妇科肿瘤中心内区分恶性肿瘤亚型和疾病程度所需步骤达成了共识(图 3)。超声评估或应用 IOTA ADNEX 模型结合肿瘤标志物(CA 125和CEA,在特定情况下辅以其他标志物)通常可以提示特定的恶性肿瘤亚型。如条件允许,可以通过弥散加权和灌注加权 MRI 确认原发病变的诊断,尤其是在考虑保留生育能力的手术的情况下。疑似恶性肿瘤的患者必须在计划手术前对胸部、腹部和骨盆进行CT扫描以排除继发性肿瘤、血栓栓塞事件和多灶性实质内远处转移。应基于多学科专家意见,综合考虑诊断和治疗,包括症状、手术史、既往史和生育史,最终确定患者的管理和治疗决策,为每位患者提供个体化医疗。
图片
图2推荐使用步骤流程图区分良性和恶性肿瘤,并引导患者进行恰当治疗
图片
图3 妇科肿瘤中心鉴别恶性肿瘤亚组和疾病程度所需步骤流程图
*不同的 ADNEX 模型(I 期与 III-IV 期)和肿瘤学(I-II 期与 I-IV 期),早期和晚期可能有所不同
