2021年度美国癌症研究协会(AACR)大会报道了一项PAPR抑制剂尼拉帕利联合放疗及免疫治疗针对小细胞肺癌的临床前研究。该研究在细胞系及动物模型中探究了尼拉帕利的放疗增敏作用及其潜在机制、放疗联合尼拉帕利对免疫应答的影响,并对尼拉帕利、放疗、抗PD-1三重联合方案在小细胞肺癌治疗上的有效性和安全性进行了评估。研究结果表明相比于放疗或尼拉帕利单纯治疗方案,放疗与尼拉帕利的联合具有更加强大的诱导小细胞肺癌细胞凋亡、抑制其增殖的能力,同时可进一步激活cGAS/STING信号通路,促进肿瘤免疫微环境中细胞毒性T细胞的浸润。而放疗、尼拉帕利、PD-1抗体的三联治疗模式可介导更强烈的抗肿瘤效果,显著抑制小鼠肿瘤体积的增长,延长其生存期,同时不引起骨髓及肝脏毒性。小细胞肺癌的治疗一直是肺癌领域的难点,该临床前研究结果,为小细胞肺癌治疗的临床转化具有重要启示意义。
尼拉帕利具有放疗增敏作用
放疗可以诱导多种类型的基因组损伤,其中最具致死性的是双链DNA的断裂。基于尼拉帕利抑制DNA单链损伤修复,通过“合成致死”和PARP酶“捕获”机制,造成DNA双链损伤的能力,该研究的工作人员通过细胞凋亡检测、克隆形成及Ki67染色等实验进一步探究了尼拉帕利是否具有放疗增敏作用。结果表明:放疗与尼拉帕利的联合相比于放疗或尼拉帕利单纯治疗具有更强的诱导小细胞肺癌细胞凋亡,抑制其增殖的能力。细胞周期参与细胞的多种生命进程,处于G2/M期的细胞对放射线最为敏感,本研究发现尼拉帕利的使用可大幅度提高处于G2/M期的细胞比例,表明尼拉帕利可能通过G2/M期阻滞而实现其放疗增敏作用。
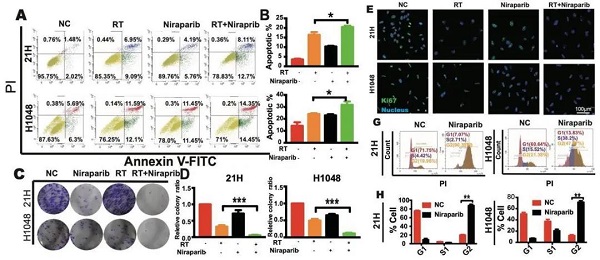
Figure 1. 尼拉帕利具有放疗增敏作用
放疗联合尼拉帕利可进一步激活cGAS/STING信号通路
有研究表明放疗诱导产生的断裂的双链DNA,可以通过激活cGAS/STING信号通路介导抗肿瘤免疫应答。该研究通过共聚焦免疫荧光染色技术探究了放疗联合尼拉帕利对于双链DNA产生的影响,结果显示二者联合可显著促进胞质中双链DNA的聚集。同时,蛋白质免疫印迹(WB)和实时荧光定量PCR(qPCR)的结果也显示cGAS/STING下游分子TBK1和IRF3的磷酸化水平显著提高,细胞因子IFN-β、CCL5及CXCL10的mRNA水平显著提高,提示放疗与尼拉帕利的联合可使该通路更大程度的激活。

Figure 2. 尼拉帕利联合放疗可以显著促进cGAS/STING通路激活
放疗联合尼拉帕利及抗PD-1免疫治疗安全性和有效性评估
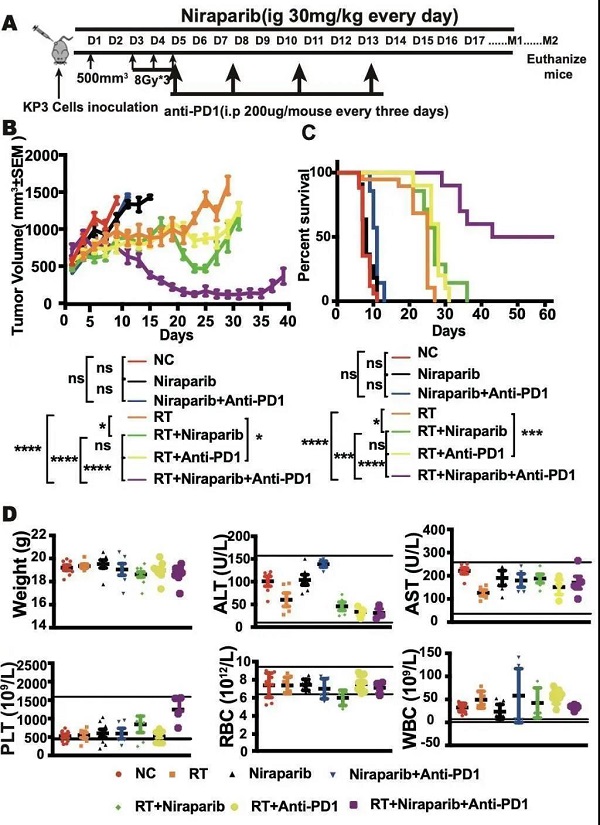
Figure 3. 体内实验表明尼拉帕利联合放疗以及抗PD-1免疫治疗具有高效低毒的特点
基于以上实验结果,该研究使用小鼠小细胞肺癌荷瘤模型,进一步评估了放疗联合尼拉帕利及抗PD-1免疫治疗的有效性和安全性。从肿瘤体积生长曲线及生存曲线可以看出放疗与尼拉帕利的联合可显著抑制肿瘤生长,延长生存期,而抗PD-1抗体的加入,显现出更加强大的抗抗肿瘤效果。同时各组小鼠的体重、红细胞、血小板、AST及ALT等指标均在参考值之内,表明该联合治疗模式没有明显的骨髓和肝脏毒性。
联合治疗模式可以改善肿瘤免疫微环境
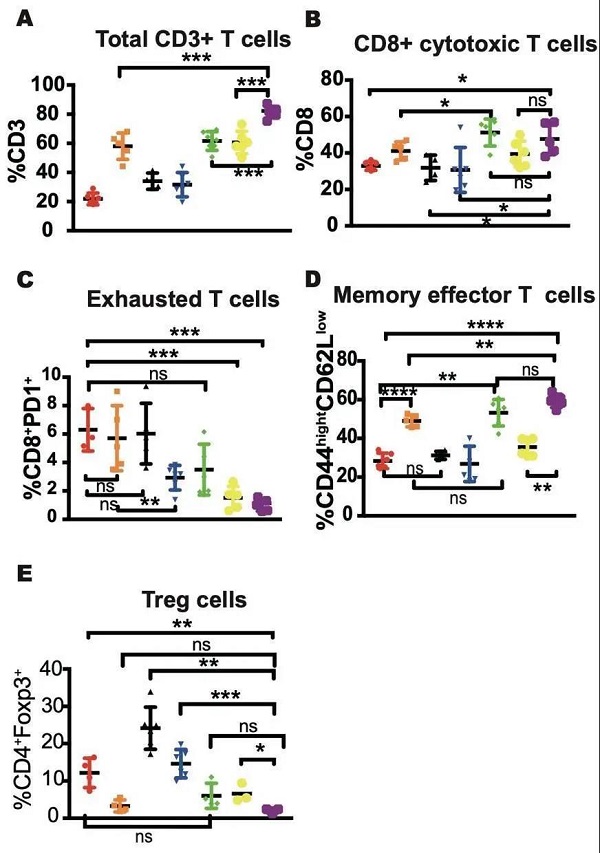
Figure 4. 联合治疗方案可改善肿瘤免疫微环境
基于放疗与尼拉帕利的联合可进一步激活cGAS/STING信号通路,并具有促进IFN-β、CCL5、CXCL10等利于T细胞募集的细胞因子产生的能力,该研究通过多色流式细胞技术分析了经过不同方式处理后肿瘤微环境中免疫细胞的分型和含量的变化。结果表明放疗与尼拉帕利的联合可显著提高CD45+CD3+总T细胞及CD45+CD3+CD8+细胞毒性T细胞的数量,同时不会引起CD45+CD3+CD4+Foxp3+调节性T细胞数量的增加。而抗PD-1抗体的加入,可使二者浸润水平进一步提高,且使CD45+CD3+CD8+PD-1+耗竭性T细胞及调节性T细胞含量进一步降低。

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
