摘要
目前,卵巢癌尚无使用来曲唑的治疗规范。因此,我们系统回顾分析有关来曲唑在卵巢癌中应用的文献。数据显示,来曲唑在原发性和复发性卵巢癌中均发挥作用。在低级别卵巢癌中,来曲唑表现出良好的疗效,特别是在维持治疗时,似乎能够确保无复发间期的延长;在复发性卵巢癌中,它也能够延长疾病的控制期。然而,最佳治疗方案的选择和生物学相关的群体的确定需要在更大的临床试验中确定。
在世界范围内,每年约有295400例新增卵巢癌病例,其中每年因该疾病而死亡病例达184800例[1]。了解上皮性卵巢癌的生物学特性,无论是对初次诊断的卵巢癌患者制定一线治疗方案,还是对复发性卵巢癌患者个体化治疗方案,均为重要的步骤[1]。尽管PARP(聚ADP核糖聚合酶)抑制剂以及抗血管生成疗法已拓宽了卵巢癌的治疗手段[1],但对新型靶向药物的需求仍在不断增长。尤其是对于组织学较不常见的亚型,如低分化卵巢癌,靶向药物显得尤为重要,因为我们不仅需要改善临床结果,同时需要保证生活质量。由于卵巢癌具有雌激素受体表达,其表达率约25%-60%。根据乳腺癌的治疗建议,内分泌疗法可常规推荐用于雌激素受体阳性疾病的维持治疗,激素治疗方案已被建议可作为卵巢癌患者的有效选择[2-5]。
来曲唑是一种非甾体芳香酶II型抑制剂,可抑制雌激素信号通路。其关键作用机制是可逆性竞争抑制芳香化酶,从而阻止了睾丸激素转化为17-β-雌二醇(E2),而不会影响其他类固醇的水平[6]。一些体外和体内模型以及临床研究已经证明雌激素阻断疗法在卵巢癌中的功效。例如,在具有ER+卵巢癌细胞系的二维和三维培养中,非甾体芳香化酶抑制剂能够以剂量依赖性方式抑制生长,表明雌激素受体(ER)在卵巢癌细胞增殖中起关键作用[4]。其次,在卵巢癌细胞异种移模型中,4-羟基-非甾体芳香化酶抑制剂的应用会导致大多数ER+卵巢癌的肿瘤生长抑制[4]。最后,在体内治疗的异种移植模型中,来曲唑能够改善的动物的存活率[6]。
总体来说,这些亚临床和临床研究均支持激素疗法在卵巢癌中的应用。目前,芳香酶抑制剂如来曲唑可作为卵巢癌复发时可选择的治疗措施,主要用于延长下次治疗的开始时间[2]。
鉴于前瞻性试验缺乏确切证据,本文用以评估来曲唑在卵巢癌治疗中的作用。我们总结了这种靶向药物在原发性和复发性卵巢癌的临床疗效,并重点介绍了增强卵巢癌对药物反应的潜在策略。
方法
在PubMed和Cochrane数据库中使用以下关键词及其不同组合搜索来曲唑在卵巢癌中的作用:“来曲唑”、“雌激素受体”、“内分泌疗法”、“芳香化酶抑制剂”、“卵巢”、“癌”、“癌症”、“高级”、“低级”、“浆液”。制定了详细的搜索策略以识别符合该主题的主要研究。文献检索仅限于人类研究的英语出版物。研究必须满足以下标准才能进行本次审查:(1)关于来曲唑对低级别和/或高级别浆液性卵巢癌患者的治疗效果的报告;(2)至少包括10名患者。评估来曲唑在其他原发性肿瘤和癌前病变中的作用的研究被排除在外。当一些国际会议摘要(欧洲肿瘤内科学会,欧洲放射治疗学会和仅当肿瘤学,美国放射肿瘤学学会和美国临床肿瘤学协会)包含我们研究的作者认为对统计学分析有益的信息时也包括在内。搜索时间终点为2019年10月。电子搜索确定了4373篇引文,在筛选之后,对21篇全文文章进行了审查以进行进一步评估,并且由于不符合纳入标准而将4篇引文排除在外(图1)。结果根据所研究的主题以及可能的组织学实体(低级别和高级别浆液性卵巢癌)进行分组。由于数据的分析方法不同,因此对数据的定性高于定量。最终总共选择了17篇手稿。根据系统评价和荟萃分析的首选报告项目(PRISMA)指南进行了评价。
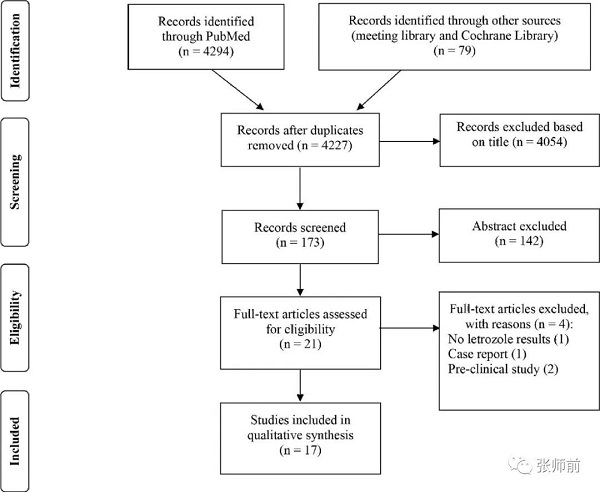
图1包括研究的选择过程
结果
初始治疗低级别浆液性卵巢癌
来曲唑可作为低级别浆液性卵巢癌患者标准方案的辅助治疗[2]。两项主要的回顾性研究记录了初次诊断为II–IV期低级别浆液性卵巢癌的妇女在标准治疗(初级手术和辅助化疗)后接受来曲唑维持治疗的临床益处。Gershenson等人评估了激素维持治疗相关的临床结局,并与初次肿瘤减灭手术和铂类为基础的化学疗法后的常规观察进行了比较[6]。总共包括203例患者(观察组n=133;激素维持治疗组n=70)。在激素维持组中,大多数患者(n=38;54%)接受来曲唑治疗。结果表明,在常规治疗后接受来曲唑维持治疗的患者中位无进展生存期显着高于常规观察的患者(64.9个月对26.4个月;p<0.001)。该益处与完成初次化疗后的残留疾病无关[6]。与接受观察的女性相比,接受激素维持治疗的患者的进展风险显着降低(HR:0.44,95%CI 0.31~0.64;p<0.001),但两组之间的总体生存率没有统计显著差异(115.7vs102.7个月)[6]。在本研究中,203例患者中有76例(37%)可获得有关ER表达的信息,只有3例ER阴性(ER-)。在所有亚组分析中(ER +,PR+和PR-患者),维持组的疗效均优于观察组。这些研究均未提示哪些患者从激素维持治疗中受益更大。由于76名有可用数据的患者中只有3名是ER-,因此不可能进行有意义的比较。
Fader等人发表的另一项回顾性研究分析了激素维持治疗对II-IV期低级别浆液性卵巢癌患者的疗效[7]。27例患者接受了细胞减灭术和单一激素的治疗。55.5%的患者服用来曲唑。中位随访41个月后,有6例患者(22.2%)复发,2例患者(7.4%)死亡。在分析时,中位无进展生存期和总生存期均未达到。3年无进展生存率为79%,3年总生存率为92.6%[7]。在这项研究中,96%的肿瘤表达ER,而只有32%的肿瘤表达PR。
最后,在最近提出的II/III期研究中,低级别浆液性卵巢癌患者随机接受了曲美替尼(MEK抑制剂)或五种标准治疗方案之一,包括紫杉醇周疗,聚乙二醇脂质体阿霉素,托泊替康,来曲唑或他莫昔芬。最终数据显示,曲美替尼显着提高了无进展生存期和缓解率。尽管如此,与标准化学疗法相比,来曲唑能够获得总体缓解率(完全和部分缓解)13%和疾病稳定70%[8]。
高级别浆液性卵巢癌
最近,来曲唑作为维持治疗的手段也在高级别浆液性卵巢癌中进行了测试[8]。一项回顾性分析纳入了FIGOIII–IV高级别浆液性卵巢癌患者共50例,经过标准治疗后,有23例患者接受来曲唑治疗(A组),而27例患者未接受任何维持治疗(B组)。所有患者ER+癌比例≥1%。两组疾病阶段比较(A组为60%FIGO III和40%FIGO IV阶段,而B组为75%FIGO III和25%FIGO IV阶段)和残留疾病发生率(R0为58%)具有可比性。来曲唑的使用与无复发间隔的明显延长有关,并且这种益处与开始使用来曲唑的时间无关[9]。其在贝伐单抗维持治疗的残留高危患者中也表现出相同的疗效。单纯应用贝伐单抗的患者20%在12个月后没有复发,相比之下,同时服用来曲唑的患者87.5%12个月后没有复发,无复发间隔为8.8个月vs21.6个月(p= 0.026)。
专家意见
鉴于其回顾性研究的特性,应谨慎看待这些数据;然而,尽管在初始手术和化疗后应用曲唑维持持续治疗的生存获益的证据级别较低,但这种干预措施适用于低级别浆液性卵巢癌的初始治疗已达成共识。鼓励进行前瞻性研究。当前的建议在表1中列出。

正在进行的试验
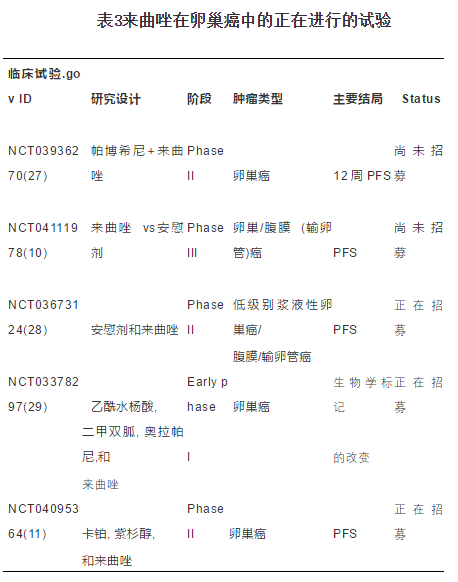
目前有两项来曲唑在卵巢癌中的应用的三期临床试验正在进行,一个是“全员”研究,另一个是低度浆液性卵巢癌特异性试验[10 11]。
名为MATAO的III期前瞻性研究(NCT04111978)旨在评估对来曲唑ER+上皮性卵巢癌(高级别或低级别)进行初步诊断后标准化疗后的疗效[10]。这是一项优势临床试验,其假设是与标准治疗相比,来曲唑治疗可增加无进展生存期。540入选的患者将以1:1的比例分配到测试组(来曲唑)或对照组(安慰剂)。每天服用一次2.5mg来曲唑和安慰剂比较剂,持续5年,直到出现毒性症状或基础疾病进展[9]。另一项III期前瞻性试验(NCT04095364)测试来曲唑联合紫杉醇和卡铂与否,对II-IV期低级别浆液性卵巢癌患者治疗结果的影响[11]。这是一项非劣效性试验,主要终点是无进展生存期。共450例患者将被随机分配至:I组(紫杉醇加卡铂的六个周期,然后每天接受一次来曲唑治疗,直至疾病进展或出现不可接受的毒性)和II组(来曲唑每天一次,直到疾病进展或出现无法接受的毒性)。
表2来曲唑在复发性卵巢癌中的II期临床试验
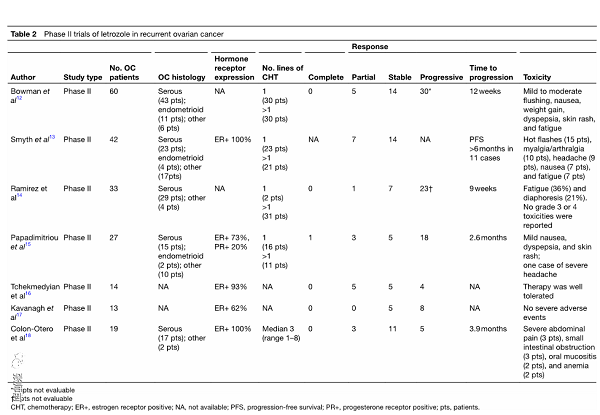
表3来曲唑在卵巢癌中的正在进行的试验
复发的治疗
目前,来曲唑可用于复发性卵巢癌的治疗[2]。获益的结果在多项II期前瞻性临床试验中得到证实[12-18]。表2列出了详细信息。大多数试验针对的患者均进行了充分的预处理且未选择激素受体的表达。来曲唑的剂量为每天2.5 mg,直至疾病进展。总体而言,结果表明来曲唑在复发性卵巢癌的治疗中具有临床疗效,且副作用最小。大约30%的患者表现出疾病稳定,客观缓解率包括完全缓解和部分缓解大约15%。常见的来曲唑相关的副作用包括恶心,疲劳,消化不良,头痛和潮热。这项研究中最大的一项试验招募了60名复发性卵巢癌患者,他们都ER水平和组织学特征各异[12]。来曲唑的抗肿瘤功效低于预期,没有完全缓解的证据。平均随访24个月(范围11-35),所有患者的平均进展时间为12周。共有12%的患者在24周内病情稳定。有趣的是,高水平的ER表达与疾病稳定相关。这一观察结果与大量乳腺癌及卵巢癌研究模型的结果一致,提示雌激素受体高表达与激素治疗缓解率之间的相关性[19,20]。
总体而言,这些II期试验结果的可能局限性主要与不清楚先前治疗方法以及组织学亚型和ER表达水平有关。尽管完全缓解率不高,但必须注意的是,有45%的患者长期稳定病情,对生活质量没有不利影响。
最近,从爱丁堡癌症中心数据库中提取的患者数据支持来曲唑在复发性卵巢癌患者中的应用[21]。总共有269例患者符合条件(n=261个高级别浆液腺癌,其中143例经过了病理评估;n=8个低级别浆液腺癌),分别有77%,19%,2%和2%的患者接受来曲唑,他莫昔芬治疗,醋酸孕甾醇或其他内分泌疗法。在38位长期缓解的病人中,29位(76%)接受来曲唑治疗。伦敦皇家马斯登医院对卵巢癌复发患者进行的回顾性分析显示了相似的结果[22]。90例高级别浆液性卵巢爱,5例高级别子宫内膜异位患者和2例透明细胞卵巢癌患者。用他莫昔芬(n = 43)或来曲唑(n = 54)治疗患者。来曲唑的反应者的反应持续时间明显长于他莫昔芬的反应者(26 vs11.5个月;p=0.03)。值得注意的是,与这些研究的回顾性相关的弱点包括选择偏倚,多重性(结果衡量),间接性(人群和干预措施的差异)和不精确性(小样本量不足以充分支持特定的理想或不良临床后果),仅允许提出假设生成结果。
总之,来曲唑在复发性卵巢癌管理中的作用仍存在争议。然而,越来越多的证据支持其在原发性和复发性治疗中的应用,以避免更多治疗的毒性作用。我们应努力确定对来曲唑最敏感的人群,并利用前瞻性研究中验证其在此类患者的作用,以改善肿瘤学结局。
联合应用策略
基于卵巢癌生物学,提出了几种优化来曲唑疗效的机制。基本原理是双重抑制细胞周期进程。耐药机制可能是ER信号传导通路与其他生长因子受体途径之间的交互作用[23]。细胞周期蛋白依赖性激酶4/6复合体(CDK4/6)可能会受到上游信号通路抑制剂的影响,例如磷酸肌醇3激酶(PI3K)抑制剂和哺乳动物靶标的雷帕霉素(mTOR)抑制剂。细胞周期中信号通路的示意图如图2所示。
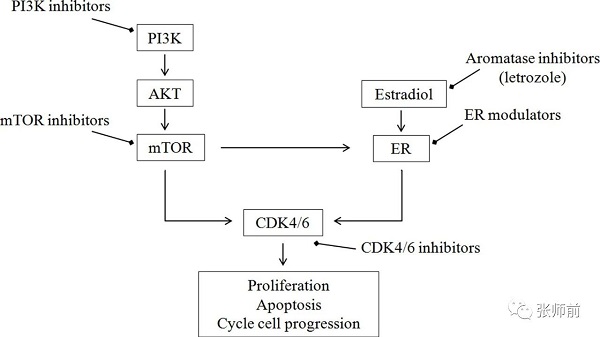
图2 信号通路及其抑制剂。CDK4/6:细胞周期蛋白依赖性激酶4/6;ER:雌激素受体;mTOR:哺乳动物靶标的雷帕霉素;PI3K:磷酸肌醇3-激酶。
E2与ER的结合导致各种信号通路的激活,包括依维莫司抑制的PI3K/AKT/mTOR通路[18]。已经发现,mTOR抑制剂(例如依维莫司)可以在一定程度上改善乳腺癌中芳香化酶抑制剂的耐药性[19]。最近的一项研究还显示了依维莫司和来曲唑的应用可以使在复发性子宫内膜癌患者在治疗中获益[19]。在此基础上,来曲唑和依维莫司的联合应用治疗复发性ER+卵巢癌也在进行中[24]。一项II期前瞻性试验的初步结果显示了对下次治疗时间的临床效益[24]。有19名患者入组(10名卵巢癌患者,7名子宫内膜癌患者,2名原发性腹膜癌患者),中位年龄为64岁。7例患者显示出疗效,包括1例部分缓解和6例疾病稳定,中位进展时间为5个月(范围5-40)。治疗普遍耐受良好;主要毒性是贫血、皮疹、疲劳、口腔炎和血糖升高[24]。
从在乳腺癌应用的经验中我们了解到,CDK4/6抑制剂和来曲唑的联合应用可以克服内分泌治疗耐药[23]。根据这一假设,一项II期前瞻性研究用以测试ER+卵巢癌患者联系服用来曲唑和核糖体利必克(CDK4/6抑制剂)12周后是否能在无进展生存期中获益[25]。纳入ER+卵巢癌患者20例(高级别浆液性卵巢癌17例,低级别浆液行卵巢癌=3例),初步结果令人鼓舞,治疗12周后有50%的患者无进展[26]。
其他的I-II期“全包含”前瞻性试验也正在进行,探讨来曲唑与核糖环素或帕博希尼(CDK4/6抑制剂)的联合应用的疗效,其中也还包含了高级别浆液性卵巢癌患者[27 28]。最后,一项对IIIa-IV期高级别浆液性卵巢癌患者的I期前瞻性研究正处于早期阶段[29]。肿瘤消减手术前,患者将接受二甲双胍(850 mg×2口服)或乙酰水杨酸(160 mg×1口服)或奥拉帕尼(300 mg×2口服)或来曲唑(2.5 mg×1口服)治疗,治疗时间为10-14天。手术后,所有患者都给予推荐的标准治疗,包括化疗和在必要时贝伐单抗巩固。肿瘤组织上生物标志物表达的变化代表了主要结果。
讨论
对卵巢癌及其不同组织学亚组认知的提高催生了基于针对特定组织学亚型及生物标志物的靶向治疗。在这种背景下,来曲唑的作用已被重新研究。首先ER表达越高,来曲唑给药的获益机会就越大,因此表明ER表达可作为激素治疗敏感性的预测指标。因此,来曲唑被推荐应用于最高表达ER的组织学亚型中,如低级别浆液性腺癌。以铂类为基础的标准化疗方案对绝大多数高级别浆液性卵巢癌(高达80%)有效,这一事实已被广泛接受。相反,ER表达水平较高的低级别浆液性卵巢癌则相对化疗耐药(反应率为4%)。因此新的治疗方案才被广泛的研究[30]。在这种情况下,应强调与标准化疗相比,来曲唑治疗在低级别浆液性卵巢癌中疗效和稳定疾病发生率的重要性[8]。大部分卵巢癌为高级别浆液性卵巢癌,对于这一部分患者内分泌维持治疗更具实验性。对这些通常对化学敏感的肿瘤,新型治疗方案的研究(例如抗激素和靶向疗法)正在进行中。数据表明,对于ER+患者,标准治疗方案后来曲唑维持治疗可能会带来无进展生存获益,这比单独使用贝伐单抗实现的疾病控制更大。在复发病例中,来曲唑的客观缓解率有限(10-15%),但却可以发现疾病稳定的病例(约30%),从而使总体疾病控制率达到40%。因此,它可能有助于保持疾病的稳定状态而不降低他们的生活质量,从而延迟后续的化疗,这是复发病例中的理想终点。
最后,除了针对于ER表达靶向治疗外,还有其他新兴的联合治疗方案可能有助于克服来曲唑耐药。有趣的是,曲唑与mTOR抑制剂或CDK4/CDK6抑制剂之间的潜在协同作用已经在乳腺癌和子宫内膜癌中表现出来。其在卵巢癌中的作用初步数据近期已发表,这些可以作为进一步临床试验的基础(表3)。
此外,减轻毒性仍然是开发卵巢癌新型药物的重要目标。来曲唑的耐受性良好,它的毒性特征主要与潮热、关节痛、肌痛潮红、乏力、头痛、高胆固醇血症、出汗增加和骨痛有关。总体而言,来曲唑的许多常见副作用类似于更年期症状,大多数为轻度至中度,且通常可控制。
总之,如果说抗血管生成疗法或PARP抑制疗法是卵巢癌治疗的基石,那么应该强调来曲唑治疗将是一种有效的替代方法,因为在特定组织学亚组其有效性被证,而且它具有良好的安全性,低成本,且易于管理。
从全身化学疗法时代到靶向癌症生物学时代的变革,迫切需要对特定的组织学亚型或分子表达的卵巢癌早期复发及维持治疗的前瞻性临床试验。并且,耐药机制需要进一步研究,以便于新的药物和联合治疗的开发。

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
