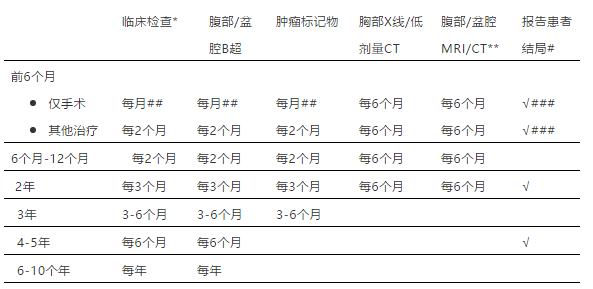
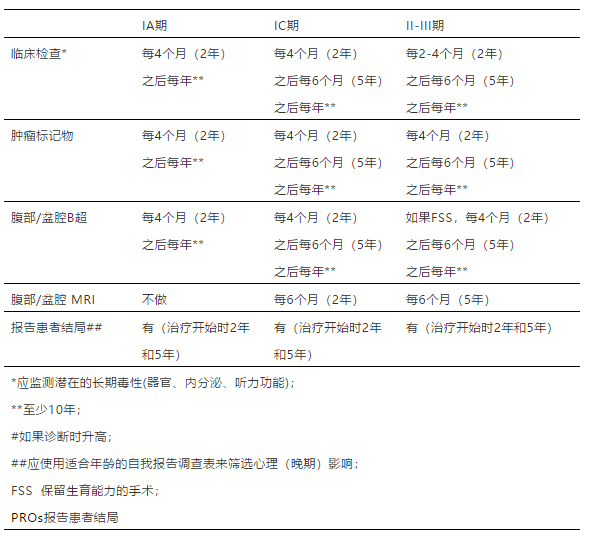
2020年7月欧洲妇科肿瘤学会(ESGO)和 欧洲儿科肿瘤学会(SIOPE)共同发布了青少年和年轻人非上皮性卵巢癌管理指南,主要针对15-25岁非上皮性卵巢癌患者,包括卵巢恶性生殖细胞瘤(MOGCT),性索间质肿瘤(SCST)和高钙血症型卵巢小细胞癌(SCCOHT)。 该指南涵盖了各种肿瘤病理类型的诊断、病理学特征、分期、辅助检查、治疗和随访,治疗方面包括早期、晚期、以及难治性/复发性疾病,明确了病理学评估和治疗的原则,该指南中AYAs定义为15至25岁的女性,尽管有些武断。 遵循五步法程序: 多学科国际发展小组提名 鉴定科学证据 制定指南 指南的外部评估(国际间审查) 整合国际评审员意见 ESGO/SIOPE指南的目标是在多学科环境中改进和统一AYAs的管理,使之适用于儿科肿瘤学家、儿科外科医生、生殖内分泌学家、心理肿瘤学家、心理学家、妇科肿瘤学家、普通妇科医生、外科医生、放射肿瘤学家、病理学家、医学和临床肿瘤学家、放射科医生、全科医生、姑息治疗团队、以及相关的健康专家。指南不包括对策略的经济学分析,任何应用或参考指南的临床医生应参照患者的具体情况确定个体化管理措施。 为确保指南内容基于客观依据,对现有文献进行了严格审查和评估。对 1998 年 1 月至2018年 5 月发表的研究进行系统文献综述。如果有充分的高水平证据支持和/或专家间已达成广泛共识,均可采用。证据的可靠性和质量参照苏格兰院校间指南网络评分系统进行分级:A 至少有一项荟萃分析、系统评价或 RCT支持,评级为 1 ++,直接适用于目标人群;评级1+ 系列研究结果具有总体一致性,直接适用于目标人群。B评级2++ 系列研究证据,结果具有总体一致性,直接适用于目标人群;或从评级1++或1+的研究中推断出的证据;C评级2+系列研究证据,结果具有总体一致性,直接适用于目标人群,或从评级为2++的研究中推断出的证据;D证据级别为3或4,或从评级为2+的研究中推断出的证据;√基于实践经验,指南制定小组推荐的专家共识。基于指南开发组临床经验的推荐最佳实践。 1 ++ 高质量的荟萃分析、随机对照试验的系统综述、或极低偏倚风险的随机对照试验 1+ 良好的荟萃分析、系统综述或低偏倚风险的随机对照试验; 2++ 高质量的病例对照或队列研究的系统综述或高质量的病例对照或队列研究,混杂或偏倚的风险非常低,因果关系的概率很高。 2+ 良好的病例对照或队列研究,混杂或偏倚风险低,因果关系概率中等; 3 非分析性研究,如病例报告、系列病例分析; 4 专家意见 一般治疗原则 √由于本指南所涵盖的各种非上皮性卵巢肿瘤非常罕见,因此应将患者转诊至包括成人和儿童专家在内的具有多学科背景的专业中心。 √治疗应由经验丰富的肿瘤学家全程参与。 √需要按照FIGO 2014分期系统进行分期。 对于疑似卵巢肿瘤的患者,术前诊断除了腹部和盆腔超声外,还应包括腹部和盆腔MRI和胸部CT检查,以及血清AFP、β-HCG,抑制素B、抗苗勒氏管激素(AMH)和乳酸脱氢酶(LDH)等。 √应测量血钙水平 √对于已完成急症手术的患者,术后应尽快完善检查,优选MRI代替CT,以减少辐射。 术前盆腔MRI有助评估是否双侧卵巢受累(如无性细胞瘤和畸胎瘤),了解肿瘤特征。 √PET-CT不推荐,阴性预测值较低。 √应避免肿瘤穿刺。 √制定手术方案应参照影像学结果,术中优选卵巢切除术,而非囊肿切除术/肿瘤切除术,尽量避免肿瘤破裂,禁止肿瘤活检,除非已有卵巢外扩散。 √首选剖腹探查术,取下腹正中切口。 仅下列情况可选择微创手术: 外科医生曾接受过腹腔镜肿瘤手术专项培训 确保肿瘤不破裂,完整切除 放入标本袋中取出,禁止分碎 充分探查腹腔 √处理肿瘤前,应取腹水或腹腔冲洗液行细胞学检查。 √全面分期手术还包括腹膜表面检查,包括膈腹膜、结肠旁沟、盆腔腹膜活检、盆腔和主动脉旁淋巴结检查和触诊,应切除肿大的淋巴结,大网膜的探查及活检,应切除粘连或异常的大网膜,检查对侧卵巢,对异常部位取活检。 在常规病理明确前,应首选保留生育功能的手术(FSS)(保留子宫和至少部分卵巢组织)。 √对于肉眼可见的卵巢外病变,应详细描述其位置和大小,并取活检。 √辅助治疗应考虑化疗药物的急性和迟发性副作用,应避免使用类固醇。 √所有AYA患者治疗前均应提供肿瘤生育咨询。 从初始治疗至随访阶段,应对所有AYA患者及其亲属提供肿瘤心理支持。 √诊断时如果肿瘤标志物升高,手术后、辅助治疗前应进行检测,每次化疗前均应检测肿瘤标志物,下降应符合半衰期。 √ MOGCT、SCST或SCCOHT的AYAs患者均应加入临床试验,对于“高危”患者,旨在提高疗效的基础上保障安全;对于“中低风险”患者,目的是保持疗效的同时降低毒性。如果没有标准治疗方案,应加入临床试验,以评估新方法的有效性;如果没有开放的临床试验,至少将研究数据报告临床登记处。 病理学评估的一般原则 √肿瘤应根据2014年WHO分类法进行分类 鉴于这些肿瘤的罕见性和误诊的重大风险,强烈建议由经验丰富的妇科或儿科病理学家研究确诊,强烈推荐病理会诊。 免疫组化和分子检测通常是诊断必需的,但许多病理实验室缺乏。 对于某些类型的肿瘤,应考虑家族性肿瘤综合征,建议进行遗传咨询,包括心理咨询和种系突变基因分析,特别是双侧GCT、单侧GCT伴条索样性腺或青春期发育迟缓、卵巢睾丸母细胞瘤(SLCT)和SCCOH。 卵巢恶性生殖细胞肿瘤 诊断、病理/分期和检查 √临床分期遵循管理原则的建议,MOGCT包括无性细胞瘤、卵黄囊瘤(YST)、未成熟畸胎瘤、胚胎癌和非妊娠性绒癌。 √应报告是否存在淋巴脉管间隙受累。 由于诊断困难,免疫组化标记有一定参考价值: SALL4:通常所有MOGCT均阳性,包括未成熟畸胎瘤中的未成熟神经上皮 OCT3/4、PLAP、D2-40、NANOG和CD117:无性细胞瘤呈阳性 PLAP:YST呈阳性 AFP和Glypican-3:YST呈阳性 OCT3/4、CD30、NANOG和SOX10:胚胎癌常呈阳性 β-HCG和抑制素:非妊娠性绒癌通常呈阳性反应。 √由于各种免疫组化标记物间存在重叠干扰和染色异常,最好使用一组标记物,而非单一标记物染色。 MOGCT存在许多特征不明的染色体和基因异常,临床意义有待评估。最常见的染色体畸变是12号染色体p臂增益,缩写为i(12p)。由于MOGCTs常发生在性腺发育不全(如Swyer综合征)的患者,建议对性染色体畸变者进行遗传学评估。 早期患者的治疗 如果超声检查发现卵巢肿瘤呈实性或部分实性,应补充MRI。 如果MRI发现实性成分,需手术治疗,也是早期MOGCT的初始治疗。 √应仔细评估手术方式,避免术中破裂。 对于双侧卵巢肿瘤,不应行双侧输卵管卵巢切除术(BSO),至少保留部分卵巢。 对于单侧卵巢实性肿瘤,应选择卵巢切除术;如肿瘤为囊性,应避免行囊肿切除术。 FSS现在被认为是年轻MOGCT患者的标准手术治疗方法。 如对侧卵巢外观正常且影像学阴性,无需进行卵巢活检。 如双侧卵巢受累(主要指无性生殖细胞瘤),建议至少保留一个卵巢的健康部分(单侧输卵管卵巢切除术和对侧部分卵巢切除术)和子宫,除非遗传分析发现性腺发育异常,后一种情况建议切除剩余卵巢。 √对于双侧卵巢肿瘤,应接受遗传咨询和心理支持。在性腺发育不良的情况下,由于存在性腺母细胞瘤和无性细胞瘤发生风险,可以进行BSO。 √根据最终病理报告,如果初次手术行囊肿切除术/肿瘤切除术,没有辅助治疗的指征,且血清肿瘤标记物已正常,则需要二次手术切除残余卵巢,以降低复发风险。当需要辅助治疗时,不必行二次手术。 √无性细胞瘤和畸胎瘤有双侧发生的风险,建议术后严密随访保留的卵巢。 C如果肿瘤疑诊恶性(分泌、囊实性包块、卵巢外扩散),如选择腹腔镜分期手术,应尽量减少肿瘤破裂风险。 √对于恶性风险低或不确定的肿块,可选择微创入路(腹腔镜或机器人)。 √如果术后确诊,应避免再次全面分期手术和淋巴结切除术。 只有术中探查和/或MRI或CT提示淋巴结异常时,才行淋巴结切除术。 对于完全切除的IA期肿瘤,术后肿瘤标志物正常或阴性,首选严密随访。 √对于IA期YST和依从性差的患者,辅助化疗(至多2周期)是一种选择。 √ IB期肿瘤的治疗较为复杂,应权衡双侧卵巢肿瘤的组织学类型。 √ IC1期MOGCT,化疗(至多2周期)或严密监测均可。 所有类型的IC2期和IC3期MOGCT患者应接受辅助化疗(至多3周期)。 晚期患者的治疗 MOGCT患者化疗敏感性高,即使晚期也应考虑FSS。 √初始治疗应避免行肿瘤细胞减灭术。 √对于化疗后仍有少数病灶残留者(腹膜、剩余卵巢和/或淋巴结)才需要手术切除。 √对于治疗后影像学上有微小病灶残留的无性细胞瘤患者,应密切随访,这些残留病灶通常无法存活。 III-IV期疾病的标准化疗在成人方案中使用,博莱霉素、依托泊苷和铂(BEP)进行3 - 4个周期,在第3周期(最大总累积剂量270 IU)后取消博莱霉素,以避免肺毒性。 对于青少年患者,可选择PEI(顺铂、依托泊苷和异环磷酰胺)、PEB(顺铂、依托泊苷和博莱霉素)或JEB(卡铂、依托泊苷和博莱霉素) 方案,化疗3-4周期。 √化疗4程后肿瘤标记物仍为阳性,则治疗失败。 √肿瘤标志物在第2程化疗后未呈半衰期下降,应视为高风险,需强化治疗方案。 √如果未成熟畸胎瘤伴有卵巢外疾病(如腹膜胶质瘤,形态上呈良性胶质组织,不含未成熟成分),腹膜病灶不需要完整切除,应多点活检,确保所有组织都是成熟的胶质成分。 难治性/复发性疾病的处理 √必须经多学科团队讨论,决定是否需要治疗以及具体治疗措施。 √如果为未成熟畸胎瘤或含有未成熟畸胎瘤成分的混合性肿瘤,化疗后复发但血清标记物正常,应考虑生长性畸胎瘤综合征(化疗后腹膜和/或淋巴结出现完全成熟的成分)。在这种情况下,如果所有组织病理都是成熟组织,只能通过手术切除,且手术为保守性,可保留子宫和部分卵巢组织。 √开始治疗前组织学证实复发至关重要。 √所有标本均应行组织学检查,以确认或排除仅为成熟组织。 对于化疗后复发的患者尚无明确推荐,化疗方案应参考既往治疗方案以及无复发间期,对于无性细胞瘤,也考虑放疗。 可以考虑在干细胞支持下强化化疗。 姑息性手术的意义尚未明确。 随访 √MOGCT管理中的监测项目基于临床检查、肿瘤标记物和影像学,具体如下: *应监测潜在的长期毒性(器官、内分泌、听力功能) ** 为避免辐射暴露,应尽可能首选 MRI; # 应使用适合年龄的自我报告调查问卷来筛选心理后遗症; ## 直到肿瘤标志物正常,然后每2个月一次; ### 在治疗之初; PROs报告患者结局 性索间质肿瘤 诊断和病理学/分期和检查 √血清AFP、β-HCG、CA-125、抑制素、AMH、钙、LDH是必需的,还应包括雌激素、脱氢表雄酮、睾酮、促黄体生成素和促卵泡激素等。 √临床分期遵循本指南一般管理原则中的建议。 多种免疫组织化标记物对诊断卵巢SCST有价值:抑制素、calretinin、CD56、melanA、CD99、类固醇样因子-1 (SF-1)、FOXL2和WT1,应联合使用,尽管标记物对诊断SCST有帮助,但准确鉴别仍有困难。 SLCT病理学报告应注明高、中、低分化,以及是否存在特殊成分:如异源成分(最常见的是粘液腺、骨骼肌或软骨组织)。所有的SLCT或两性母细胞瘤患者均应筛查DICER1综合征相关的疾病,特别是甲状腺疾病和其他罕见肿瘤,进行DICER1基因分析及遗传学咨询。 D由于性激素的分泌可能导致子宫内膜病变(增生和/或子宫内膜样癌),对于成人型颗粒细胞瘤患者,建议常规子宫内膜取样。 √没有数据支持AYAs患者行子宫内膜取样的必要性。 √但应进行影像学检查评估子宫内膜的厚度。 √PET-CT检查证据不足。 早期治疗 全面分期手术包括腹水或腹腔冲洗液细胞学检查、探查对侧卵巢、腹膜和任何可疑病变多点活检、大网膜活检或结肠下大网膜切除,不建议行系统性淋巴清扫,仅在影像学或术中探查发现可疑淋巴结时才行淋巴结切除术。 全面分期术后确诊的IA期患者可仅观察,但低分化的SLCT或有异源成分的SLCT或有网状结构的SLCT,应考虑辅助治疗。 IA期以上的患者需要化疗。 √IC1期颗粒细胞瘤患者可仅行手术治疗。 所有IC2、IC3期幼年型颗粒细胞瘤及所有IC 期SLCT均应接受辅助化疗,推荐3-4程含铂化疗。 晚期治疗 √由多学科团队制定手术治疗决策。 推荐化疗,最常用方案是BEP和PEI,至少4程。 对于SCST患者,如果顺铂禁忌,可选择卡铂/紫杉醇。 √对于III期患者和化疗后评估手术不能达到满意减灭术的患者,可给予新辅助化疗,延迟手术。 难治性/复发性疾病的处理 √必须经多学科团队讨论,决定是否需要治疗以及具体治疗措施。 √治疗取决于复发部位、有无播散、无复发间期、既往治疗和组织学类型。 最大程度的二次减瘤术是复发患者治疗的最佳选择。 在临床试验中优先考虑的其他治疗方案是:激素治疗和抗血管生成或靶向药物单独或联合治疗。 随访 √随访基于临床检查,肿瘤标志物和影像学,具体如下 √SLCT和种系DICER1突变的患者应筛查其他相关疾病,包括甲状腺疾病(多结节性甲状腺肿、甲状腺癌) 高钙血症型卵巢小细胞癌(SCCOHT) 诊断和病理学/分期和检查 √如果在术前疑诊高钙血症型卵巢小细胞癌,则术前检查应包括腹部/胸部CT扫描,血清CA-125,血钙,嗜铬粒蛋白A和神经元特异性烯醇化酶(NSE)。 √PET-CT意义不明确。 √手术应由经验丰富的手术团队完成,范围广泛,类似于上皮性卵巢癌。 由于诊断困难,需要与各种小圆细胞瘤鉴别,SMARCA4(BRG1)免疫组化可能很有价值,超过95%的肿瘤表达缺失,SMARCA4(BRG1)、SMARCA2(BRM)双重表达缺失可能更有意义。 由于不少病例存在gSMARCA4突变,因此所有SCCOHT患者均应接受遗传咨询和gSMARCA4测序。 √对于SMARCA4突变携带者,定期随访腹部超声和MRI是否有效尚不确定。 √应与健康的SMARCA4突变携带者讨论预防性卵巢切除术,但由于缺乏外显率数据,卵巢最佳切除年龄尚未确定。 早期治疗 I期患者的手术治疗包括经腹子宫全切术和双侧卵巢输卵管切除术、腹膜活检以及盆腔及主动脉旁淋巴结切除术,由于预后不良,强化辅助治疗后复发的风险仍然较高。 不建议保守性手术。 辅助化疗一般是以铂为基础的联合化疗(通常是顺铂和依托泊苷)。 可考虑铂类联合紫杉醇。 化疗后可行放疗,其意义尚不明确。 初治患者化疗缓解后,可在干细胞支持下行剂量密集化疗等多模式巩固治疗。 晚期治疗 对于初治或新辅助化疗后的患者,应行最大程度的肿瘤细胞减灭术达到完全切除,包括腹膜转移瘤、大网膜、盆腔和腹主动脉旁淋巴结。 术后推荐铂类/依托泊苷联合化疗6程。 对于初次手术和化疗后完全缓解的患者,可在干细胞支持下行剂量密集化疗和盆腔放疗。 难治性/复发性疾病的处理 没有标准的治疗方法。 √强烈推荐进行抗肿瘤新药临床试验。 随访 √建议行肿瘤生育咨询,没有明确的随访策略。由于该病侵袭性强,建议多学科协作,密切随访。 Sessa C, Schneider DT, Planchamp F,et al. ESGO-SIOPE guidelines for the management of adolescents and young adultswith non-epithelial ovarian cancers. Lancet Oncol. 2020, 21(7):e360-e368 扫二维码 关注OC资讯 OC资讯小助手 为您提供更多帮助