在本次BOA/BOC线上大会上,昆明医科大学第三附属医院(云南省肿瘤医院)杨宏英教授为我们详解了2020 v1版美国国家综合癌症网络(NCCN)卵巢癌临床诊疗指南的更新要点。
卵巢癌发病现状及管理策略
解读指南之前,杨宏英教授首先为我们总结了目前的卵巢癌发病现状。世界范围内,卵巢癌约占女性癌症的4%,每年新发病例295.4万例,死亡184.8万例。卵巢癌是女性生殖系统肿瘤中死亡率最高的一种,被称为“沉默的杀手”。
因此,卵巢癌的全程管理非常重要。卵巢癌全程管理有三大关键策略:
手术尽可能达到R0;
足疗程含铂化疗;
重视维持治疗。
卵巢癌2020 v1 NCCN指南更新——手术篇
■ 一般手术原则
大部分情况下,卵巢癌手术首选开腹手术,足够长的腹部垂直正中切口;
临床早期且肿瘤体积小或评估新诊断晚期或复发的患者是否能达到最佳肿瘤细胞减灭术,可以由有经验的妇瘤医生进行微创手术,手术不理想者应中转开腹;
外科医生应在手术记录中描述以下内容:术前盆腔、腹部肿瘤的范围,以及减瘤术后残留病灶的部位、数量、大小和数目。
初治局限于卵巢或盆腔的浸润性上皮性卵巢癌手术,应尽最大努力切除盆腔、腹部或腹膜后所有病灶:
抽取腹水或腹腔冲洗液行细胞学检查,对腹膜表面进行全面视诊,切除大网膜;
切除子宫和双附件,尽力完整切除肿瘤并避免肿瘤破裂;
期望并符合保留生育功能指征的患者,可考虑行单侧附件切除术或切除双侧附件保留子宫;
切除腹膜后淋巴结至少达到肠系膜下动脉水平,最好达到肾血管水平。
早期全面分期手术,必须切除淋巴结!
初治累及盆腔和上腹部的浸润性上皮性卵巢癌手术步骤:
尽最大努力切除所有盆腔、腹部和腹膜后肿瘤病灶,满意减瘤术标准为残余肿瘤病灶直径<1cm,尽量达到无肉眼残留病灶(R0);
切除能够切除的肿大或可疑淋巴结,临床阴性的淋巴结不需要切除(基于LION研究结果);
盆腔外肿瘤病灶≤2cm者(即IIIB期)必须行双侧盆腔和主动脉旁淋巴结切除术;
为达到满意的减瘤术,可根据需要切除肠管、阑尾、脾脏、胆囊、部分肝脏、部分胃、部分膀胱、胰尾、输尿管及剥除膈肌和其他腹膜;
减瘤术后残余小病灶的卵巢上皮性癌或腹膜癌的患者,是腹腔化疗的适应症,可以考虑在初次手术时放置腹腔化疗导管。
淋巴结切除术:
对于局限于盆腔的卵巢癌以及保留生育功能,需进行全面分期手术以排除隐匿性病灶;
对于累及盆腔和上腹部的卵巢癌,必须切除可疑转移或增大的淋巴结,临床阴性淋巴结可以不切除;肿瘤超出盆腔但转移灶≤2cm者,需行盆腔和腹主动脉旁淋巴结切除术;
新辅助化疗(NACT)后的中间型肿瘤减灭术(IDS)也应尽量达R0水平,必须切除肿大或可疑淋巴结,切除初次诊断时有潜在转移的淋巴结。
可以不切除淋巴结的情况:
交界性肿瘤;
临床明确的早期儿童/青春期生殖细胞肿瘤;
性索间质肿瘤。
不全分期手术处理:
无残留病灶的IA或IB期,若考虑观察,需全面分期手术;
无残留病灶的IC-IV期,需辅助治疗;
疑似有残留病灶且仍可切除,需行瘤体减灭术;
疑似有残留病灶且无法切除,需行NACT+IDS。
■ NACT+IDS
IDS包括完成子宫切除术和双侧输卵管卵巢切除术(BSO)与分期,应在3~4个周期的NACT后实施IDS。
NACT:
2018年指南强调在第4疗程前评估;
2019年指南:最好3疗程,也可以根据医生经验4~6疗程;
2020年指南更新:①化疗前必须有组织学证据,最好活检,也可以用腹腔镜评估;②不能活检,则需腹水或胸水细胞学+CA125/CEA的比值>25;③手术时机根据患者相关情况调整:化疗3~4疗程后病情缓解者,行IDS以及后续辅助治疗;化疗3~4疗程后稳定者,立即IDS或继续化疗至6疗程再行IDS+术后化疗;化疗3~4疗程后进展者,按复发治疗;④III期IDS后顺铂(100mg/m2)腹腔热灌注化疗。
无论NACT还是IDS,其目的都是手术争取达到R0。
如何选择NACT获益人群:
通过影像或腹腔镜评估,广泛IIIC期无法达到满意的肿瘤细胞减灭术;
IV期患者(切除率<10%);
全身状况差,无法耐受手术的患者;
缺乏有经验的妇瘤手术团队。
■ 选择初始减瘤术(PDS)或NACT+间歇性减瘤术
晚期卵巢癌
估计能够达到满意减瘤的,可考虑行PDS;
在一线治疗方案选择中,NACT并非总是PDS的替代方案;
估计无法手术或满意减瘤可能性较低的,可考虑先予以化疗;
病理类型和基因突变状态也可能影响患者治疗方案的选择。
■ 二次肿瘤细胞减灭术
尽管GOG213研究结果不支持二次手术,欧洲DESKTOP III研究则显示铂敏感复发(PSR)卵巢癌行二次减瘤术,患者可有无进展生存(PFS)获益;总生存(OS)数据还不成熟。
2020美国临床肿瘤学会(ASCO)会议上,DESKTOP III研究公布的结论支持二次手术:
对于无铂间期>6个月以及通过AGO评分筛选的患者,肿瘤细胞减灭术可显著延长患者的OS及PFS;
仅在手术完全切除的患者中观察到OS获益,且获益最多(若达到完全切除,中位OS延长12个月以上);
强调优化选择患者(例如通过AGO评分)以及优化选择拥有专业知识和更大概率取得完全切除的医疗中心的重要性。
因此,2020NCCN指南指出,可以选择二次肿瘤细胞减灭术的条件为:
PSR(初次化疗结束后>6~12个月复发);
孤立(或局限性)病灶适合完全减灭;
无腹水。
鼓励病人参加临床试验,评估二次减瘤术是否能真正获益。
卵巢癌2020 v1 NCCN指南更新——化疗篇
2020年指南基本维持既往的化疗原则和化疗指征不变,但详细规定了化疗药物的剂量;按临床病理分期将化疗方案按照首选推荐、其他推荐以及特定条件下有用方案进行分类,并将其表格化,更加有利于妇瘤科医生的临床应用。
2020年指南推荐恶性性索间质肿瘤初始及复发后化疗首选为TC方案(EP方案也列为2A证据;而BEP方案后移到特定条件下有用的选择)。癌肉瘤化疗首选为TC紫杉醇175mg/m2卡铂方案。
不同分期和类型卵巢癌化疗方案见表1~3:
表1 I期卵巢上皮性癌/输卵管癌/原发性腹膜癌初始全身治疗方案
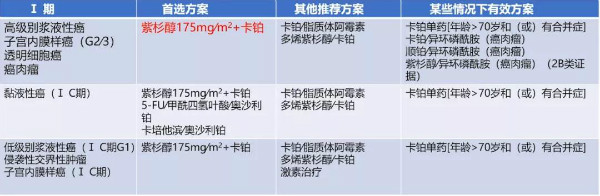
对于I期患者:高级别浆液性,建议6个周期;所有其他卵巢癌类型,3~6个周期。
表2 II~IV期卵巢上皮性癌/输卵管癌/原发性腹膜癌初始全身治疗方案
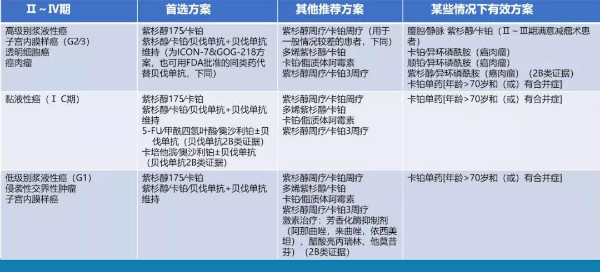
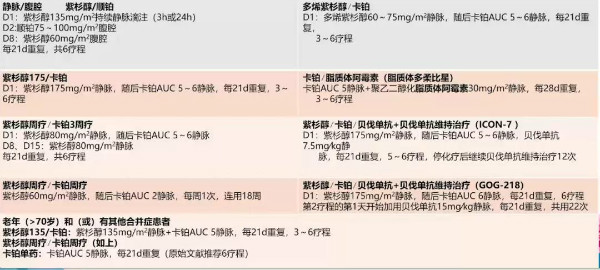
表3 卵巢上皮性癌(包括特殊情况)/输卵管癌/原发性腹膜癌化疗方案
对于复发性卵巢癌、输卵管癌或原发性腹膜癌的化疗方案,则是基于铂敏感与否来进行分类选择,见表4~6:
铂难治:铂类治疗中或结束铂类治疗4周内疾病进展;
铂耐药复发:结束铂类治疗1~6个月疾病进展;
铂部分敏感复发:结束铂类治疗6~12个月疾病进展;
PSR:结束铂类治疗12个月以上疾病进展。
表4 PSR卵巢上皮性癌(包括少见病理类型)/输卵管癌/原发性腹膜癌全身治疗方案
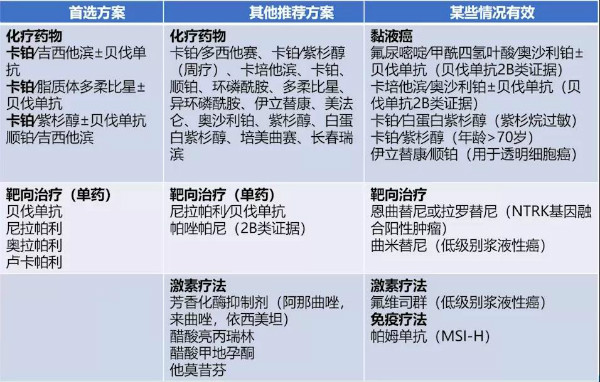
铂敏感方案的选择原则:
初始一线方案均可选择;
首选含铂联合方案;
铂类仍首选卡铂或顺铂;
至少6疗程;
不推荐体外药敏检测;
美国以含有PLD和贝伐单抗方案最常用;
治疗目标是尽量延长无铂间期。
表5 铂耐药复发性卵巢上皮性癌(包括少见病理类型)/输卵管癌/原发性腹膜癌全身治疗方案
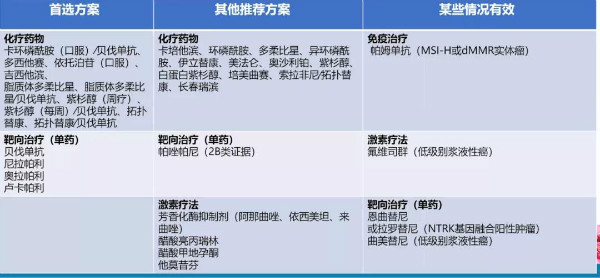
表6 铂耐药复发性卵巢癌/输卵管癌/原发性腹膜癌推荐药物
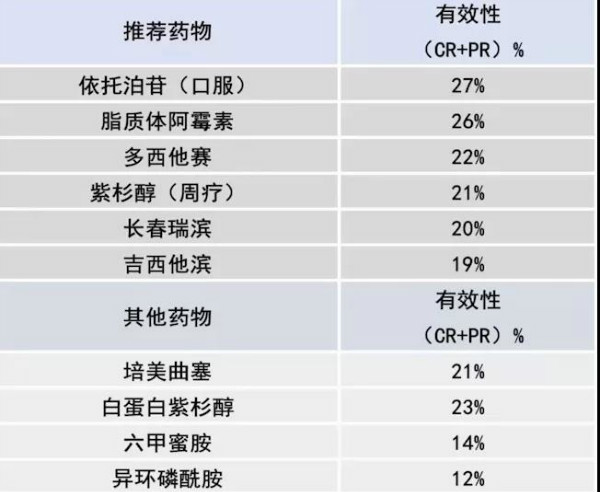
非铂类单药化疗:
无首选化疗药物;
权衡药物的疗效和毒性;
特别关注患者生存质量;
鼓励患者加入临床试验。
少见病理类型卵巢恶性肿瘤的化疗方案见表7~10:
表7 2020NCCN恶性生殖细胞肿瘤初始治疗方案

表8 2020NCCN恶性生殖细胞肿瘤复发治疗方案

表9 2020NCCN恶性性索间质肿瘤初始治疗方案

表10 2020NCCN恶性性索间质肿瘤复发治疗方案

卵巢癌2020 v1 NCCN指南更新——维持治疗篇
■ 一线维持治疗
PARP抑制剂从PSR走到一线:
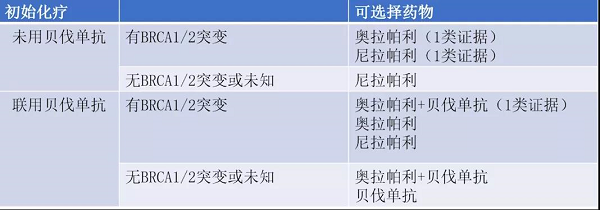
新增尼拉帕利,奥拉帕利+贝伐单抗用于一线维持;首次一线引入同源重组缺陷(HRD)检测;
贝伐单抗推荐减少,单药仅用于既往使用贝伐且BRCA野生型/未知。
卵巢癌初治后一线维持治疗(表11):
适用于II-IV期患者初始治疗完全缓解/部分缓解(CR/PR)者,不适用于I期、稳定和进展者;
存在胚系和/或体系BRCA1/2突变提示需要维持治疗;
在没有BRCA1/2突变的情况下,HRD状态可能提供关于PARP抑制剂治疗获益程度的信息(2B类证据)。
表11 II~IV期卵巢癌初始治疗后CR/PR的维持治疗
■ 其他靶向治疗
抗血管生成药物:以贝伐单抗为代表,几乎适用于所有实体肿瘤,并不需要依赖肿瘤基因检测结果。在卵巢癌一线化疗中加上贝伐单抗可提高缓解率,扩大PARP抑制剂适用人群,化疗缓解后可选择奥拉帕利+贝伐单抗或尼拉帕利单药维持治疗。
免疫治疗:目前免疫治疗在卵巢癌治疗中使用率还不高,需根据基因检测结果选择可能有效的靶向药。
■ 其他更新点
低级别浆液性/子宫内膜样癌术后可选择化疗或激素治疗;
可选择冰帽冷却头皮减少脱发;
恶性生殖细胞肿瘤中非无性细胞瘤的随访时间缩短:术后2年内间隔为2个月;
黏液性癌检查项目增加CA199,初次手术时阑尾外观有异常才切除。
小结
■ 一线维持治疗
推荐肿瘤分子检测,至少包括BRCA1/2、微卫星不稳定性(MSI)或错配修复缺陷(dMMR),可考虑HRD检测及其他肿瘤细胞检测项目;
癌肉瘤化疗首选TC方案;
恶性性索间质细胞肿瘤初始治疗首选TC方案,证据从2B类改为2A类;
卵巢上皮性癌不全分期手术后的处理主要根据有无肿瘤残余;
可考虑使用头皮冷却减少化疗导致的脱发;
一线维持治疗有重要更新,根据初始化疗是否联用贝伐单抗及有无BRCA1/2突变选择药物。

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
