血清糖类抗原125(CA-125)是目前应用最广泛的卵巢癌生物标志物检查,是浆液性癌的首选肿瘤标志物。早期卵巢癌多局限于盆腔,受腹水等因素影响小,相较于晚期,血清CA-125在早期卵巢癌中可以更好预测预后。此次我们邀请来自首都医科大学附属北京妇产医院的康海利教授为大家解读一篇2022年10月发表在《Journal of Gynecologic Oncology》的:化疗前血清CA-125在早期高危卵巢癌中的临床和预后意义:一项NRG/GOG研究补充分析[1]。


 00:000:00 音频
00:000:00 音频
01 背景介绍
1-肾功能损伤是卵巢癌化疗过程中常见的严重并发症,目前指南尚无标准应对方案
2020年全球卵巢癌发病人数高达31万,其中,中国卵巢癌发病人数为6万。尽管初次手术时行最大程度地肿瘤细胞减灭,并采用铂类辅助化疗,超过50%晚期卵巢癌患者仍会复发。复发患者首选以铂类为基础的联合化疗,对于铂耐药性卵巢癌,推荐使用非铂药物,如多西紫杉醇、依托泊苷和紫杉醇等,但由于其药物作用的非特异性,在抑制和杀伤肿瘤细胞的同时,也对生长较快的正常细胞也有抑制和杀伤作用,肾功能损伤是恶性肿瘤及化疗过程中常见的严重并发症。目前有关化疗导致妇科恶性肿瘤肾功能损伤及后续应对策略的报道较少,化疗引起肾功能不全是临床不容忽视的问题,肾损伤极大的限制了患者后续化疗治疗方案的使用,导致患者病死率增高,对于化疗不耐受的患者,亟需探索新的治疗手段。
2-“去化疗”方案为解决肾功能损伤问题提供思路
近年来, PARP 抑制剂、抗血管抑制剂和免疫检查点抑制剂的出现,激起了学术界对卵巢癌复发后去化疗(chemotherapy?free)处理的广泛争议和讨论。为解决卵巢癌化疗不耐受问题提供了新思路和新方向。PARP抑制剂如尼拉帕利和奥拉帕利,也曾被 FDA批准作为 BRCA突变的复发卵巢癌患者后线治疗,NOVA研究是首个针对尼拉帕利对于铂敏感复发性卵巢癌患者维持治疗的研究,无论BRCA突变与否,尼拉帕利均可显著降低患者疾病进展风险,提高全人群的中位PFS。安罗替尼是一种口服小分子酪氨酸激酶抑制剂,抑制肿瘤血管生成和生长,对血管内皮生长因子受体2/3(VEGFR2/3)等靶点具有广泛的抑制作用。PARPi在DNA损伤修复过程起着关键作用,有研究表明抗血管生成药物可以诱导瘤体内缺氧状态,低氧状态会改变DNA损伤修复通路,包括同源重组通路(HR)导致基因复制不稳定,增加PARP抑制剂的敏感性,抗血管生成抑制剂与PARP抑制剂在机制上存在协同作用,抗血管生成抑制剂与PARP抑制剂的早期临床试验提示我们这种组合可能带来不错的疗效,更小的毒副作用,给与患者更长的无化疗间期,值得进一步探索。来曲唑是一种非甾体芳香化酶抑制剂,可抑制雌激素信号通路。其关键作用机制是对芳香化酶的可逆竞争性抑制,而不影响其他类固醇的水平。既往研究表明,来曲唑可延长复发性高分化浆液性卵巢癌的无复发间隔,特别是在用作维持治疗时;在复发病例中,它也可使疾病得到长期控制。
3-本病例的临床附加价值
去化疗是未来复发性卵巢癌治疗讨论的热点,对于化疗不耐受的卵巢高分化浆液性腺癌患者,以尼拉帕利为基础的去化疗治疗是一个不错的选择。在这里,我们报告了一例初诊年龄为41岁女性卵巢高分化浆液性乳头状腺癌患者。在经历多线化疗反复出现IV度骨髓抑制并最终导致难以逆转的肾功能损伤后,患者开始接受尼拉帕利联合安罗替尼治疗,疾病得到控制,患者反应良好,在取得11个月的无进展生存期后,疾病再次进展,患者改用尼拉帕利联合来曲唑,并治疗至今,最新CT未见复发迹象,据我们所知,针对化疗引起严重肾功能损伤的卵巢高分化浆液性腺癌患者,还没有发表过以尼拉帕利为基础的去化疗方案探索性治疗的案例。
02 病例介绍
患者,女,41岁,于2009年8月因体检评估卵巢囊肿住院。无痛经、腹胀、腹痛、排便异常、恶心、呕吐。既往病史、家族史及社会心理史无特殊。经妇科双合诊检查,子宫大小、质地正常而可触及边缘不清晰的附件包块。经阴道超声检查:右侧卵巢肿瘤,大小74×63mm,内见实性隔室。血清CA-125水平升高(1428U/mL[正常范围,<35U/mL])。患者接受卵巢癌细胞减灭术(R0;包括子宫切除术、双侧附件切除术、网膜切除术、膀胱前肿瘤和直肠前肿瘤切除术以及盆腔淋巴结清扫),并接受辅助铂类药物化疗。术后病理学结果为双侧卵巢高分化浆液性乳头状腺癌、大网膜纤维脂肪组织中见癌巢浸润、膀胱表面肿物、直肠前肿物纤维脂肪组织中可见癌侵犯、右髂外淋巴结转移癌,术后行多西他赛(90mg)+卡铂(450mg)静脉化疗6疗程。。2016年4月(第1个疗程含铂化疗结束后6年),患者CA-125水平升高(258U/mL),CT 成像显示腹部转移。患者在另一家医院接受了第二次肿瘤减灭术。第2次减瘤术后给予紫杉醇(210mg)+卡铂(450mg)静脉化疗6个周期(图1)。化疗后患者CA-125水平降至正常范围(图1)。
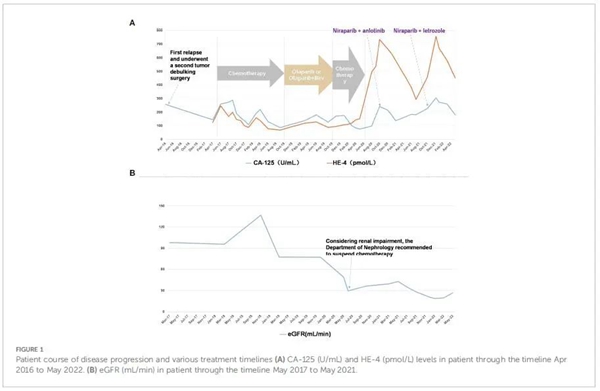
2017年4月(第二次手术后1年),患者再次复发,右侧纵隔腹膜后淋巴结和CA-125(144U/mL)水平升高支持该结果。此后因肿瘤进展或个人原因,接受了多种治疗方案,具体治疗方案总结见表1:
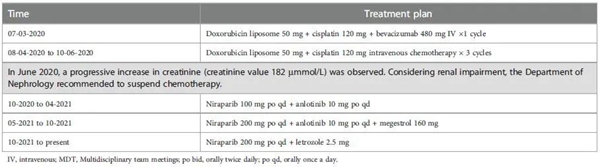
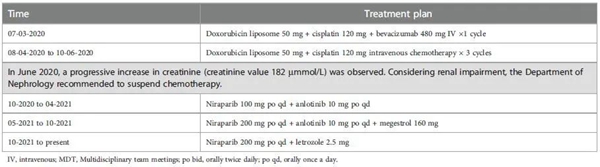
2017年5月至2017年11月,患者接受不同剂量的紫杉醇+卡铂和吉西他滨+顺铂联合治疗,导致 IV级骨髓抑制,即使减量后仍未改善。患者改为不同剂量的多西他赛+顺铂给药至2018年2月,随后肿瘤的快速进展,肿瘤的基因检测显示BRCA1和BRCA2无突变,而检测到UGT1AI*6、UGT1A1*28、UGT1A1-3156基因多态性。2018年4月至2018年10月,给予患者伊立替康和贝伐珠单抗静脉给药,每3周一次,共7个周期。2019年1月至2019年10月,应患者要求,改用靶向治疗(奥拉帕利单药或联合贝伐珠单抗)。由于肿瘤进展,患者从2019年11月至2020年6月接受了多柔比星、顺铂和贝伐珠单抗组合治疗。随后检测出肌酐水平进行性升高,提示肾损害(图 1),经肾内科会诊后停止化疗。自2020年10月起,患者接受去化疗方案(尼拉帕利、安罗替尼和甲地孕酮)。获得11个月PFS后,疾病再次进展,患者从 2021年10月开始改用尼拉帕利联合来曲唑。截至数据截止日期(2022年5月30日),患者仍在接受治疗。
03 讨论
在本病例报告中,1例41岁的复发性高分化浆液性卵巢癌患者在二次细胞减灭术后出现铂耐药。多线化疗后,由于骨髓抑制、肾损害和其他因素,进一步发现难以继续化疗。而尼拉帕利联合抗血管生成药物显示出较好PFS。进展后再选择尼拉帕利联合来曲唑进行进一步治疗,再次获得缓解,且毒性较低,提示PARPi联合来曲唑可能对化疗不耐受的高分化卵巢浆液性腺癌患者有益。该病例的局限性在于没有临床指南或试验可预测尼拉帕利和来曲唑联合给药在肾损伤患者中的疗效和毒性。同时,在靶向药物中,存在许多直接或间接影响肾脏的脱靶和不良反应。
近年来卵巢癌靶向治疗取得了重大进展,去化疗也成为卵巢上皮性癌研究领域的热点问题。为解决卵巢癌耐药和化疗不耐受问题提供了新思路和新方向。去化疗处理作为替代化疗的手段,其出发点是让患者免受化疗所带来的躯体和心理痛苦,遵循有效、无毒和经济适用的原则。PARPi、抗血管生成抑制剂的涌现,为去化疗处理增添了新的抗癌“武器”,PARP抑制剂联合抗血管生成抑制剂,会不会比标准化疗后的维持治疗取得更好的效果,值得进一步探讨。从AVANOVA2研究可以看出,在没有BRCA突变的患者,PARP抑制剂联合贝伐珠单抗可以取得很好的效果,这就提示我们,可以将不同作用机理的药物进行联合,如PARP抑制剂联合抗血管生成,让更多临床上多线化疗失败或无法耐受化疗的患者临床获益。2022年3月在SGO年会上,中山大学肿瘤防治中心刘继红教授团队汇报了尼拉帕利联合安罗替尼(ANNIE)治疗铂耐药卵巢癌的安全性及疗效数据。其结果显示:总体人群客观缓解率为50%,中位无进展生存期为8.3个月。这对于铂耐药卵巢癌来说,将又是一个新的治疗选择。
在本案例中,患者先后经历了奥拉帕利单药及联合贝伐单抗,但都未能有效控制疾病进展,考虑到尼拉帕利在BRCA阴性人群维持治疗也能够获益,改为尝试尼拉帕利联合安罗替尼治疗,患者中位无进展生存期为11个月,显示了一定的抗肿瘤活性,而且对于肾功能不全的患者安全性是可以接受的。PARPi的广泛应用也产生了PARPi后 PARPi再挑战问题。2021ESMO会议上OReO研究公布的研究结果表明,与安慰剂相比,无论BRCA状态如何,在对铂类化疗有反应后再次PARP抑制剂维持治疗有改善PFS的趋势,亚组分析显示再次进展后后使用不同PARPi似乎获益更明显。本病例中,患者既往已使用奥拉帕利+贝伐单抗维持治疗,但肿瘤持续进展。更换尼拉帕利和安罗替尼治疗后,患者疾病得到控制,中位无进展生存期为11个月,这也说明了PARPi治疗进展后,再次换用另一种PAPRi同时联合抗血管生成药物仍可能会获益。
尽管PARP抑制剂、抗血管生成药物治疗等已经增加了复发性卵巢癌的治疗选择,但是对于少见的组织学亚型,如高分化浆液性卵巢癌,可选择的方案仍然有限,来曲唑可作为复发性卵巢癌的一种治疗选择,其临床获益也在几个II期前瞻性试验中也得到了证实。患者2021年10月肿瘤再次进展,在口服尼拉帕利基础上加入来曲唑,暂无肿瘤进展证据(最后随访日期2022年5月)。PARPi与来曲唑联合用药的作用机制尚未明确,但在本案例中确实显示出了一定的抗肿瘤作用,并且此方案对肾功能不全患者的安全性是可接受的。但本案例作为单个病例,未来仍需大宗临床试验进一步探索其有效性和安全性。
04 讨论
对于铂耐药复发性卵巢癌,我们的目标是改善临床结果,同时保持一定的生活质量。晚期铂耐药复发性卵巢癌多线化疗进展后或因为化疗毒副反应无法耐受,改用抗血管药联合PARPi治疗可能是一个不错的选择。同时,前序PARPi治疗后进展,再次使用其它类PAPRi联合抗血管生成药物也仍可能会获益。更重要的是,来曲唑在卵巢癌低级别浆液性腺癌的应用应重新得到重视。由于此病例患者为个案,我们仍需进一步探索联合使用药物的有效性及药物毒副作用。
患者自评
2009年医生告知我得了卵巢癌,而且还是晚期时,我是难以置信的,因为我才41岁,之前没有任何的不舒服,经历了好长一段时间的沮丧,在家人和医护人员的耐心开导下,我逐渐接受了这个事实,并开始打化疗。化疗前,我和所有人一样,十分恐惧,因为我听说化疗会掉头发、会呕得很厉害、会吃不下东西、会腰酸骨痛等等。化疗过程中,我经历了以上所有的不舒服,并且一度有了放弃治疗的想法。每次到医院复查都心惊胆战的,会不会这个指标不好了、会不会那个指标升高了。这十多年来,我不断地被告知复发了,要用药了。一次又一次地化疗已让我的思想麻木了,我深知什么时候呕得最厉害、什么时候会缓解、打完化疗后头发多久才能张出来,但最后我还是顶不住了,我觉得化疗要把我打垮了、身体被掏空了。口服靶向药物让我回归了正常的生活,不用三天两头往医院跑,我现在可以做家务、旅游了,虽然我深知有一天我还是会被告知肿瘤复发了,但我依然享受现在的每一天。
参考文献:1.Front Oncol. 2023 Jan19;12:1031045.doi: 10.3389/fonc.2022.1031045.eCollection 2022.

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
