在临床研究中,往往安慰剂组中也有一定比例的不良事件,是什么原因引起的呢?因为疾病本身,还是因为安慰剂的使用?一篇题为《Adverse events in the placebo arm of maintenance therapy trials in advanced ovarian cancer: A systematic review and meta-analysis》的文章于2022年5月发表于《European Journal of Cancer》杂志。
本期我们邀请到宁波市妇女儿童医院的汪期明医生为大家解读,晚期卵巢癌患者在维持治疗的临床研究中,安慰剂组发生不良反应的情况。


 00:000:00 音频
00:000:00 音频 维持治疗是新诊断或铂敏感复发性卵巢癌在化疗缓解后的标准治疗。维持治疗期间的不良事件较为常见,通常可归因于试验性治疗,但也可能不相关。
本研究根据系统综述和荟萃分析指南的首选报告条目在MEDLINE和Embase数据库进行了检索,时间范围从建库至2021年4月,纳入分析的试验需符合:
安慰剂单药对照的随机设计
双盲
患者在含铂化疗缓解后接受维持治疗
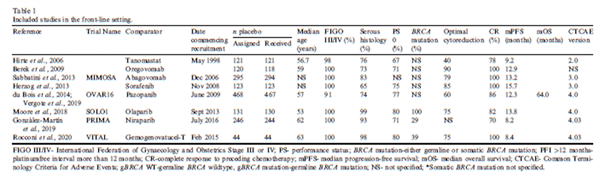
本研究纳入了13项试验,共有2224例患者接受安慰剂治疗。其中,8项试验为新诊断卵巢癌(N=1541,69.3%),5项试验为铂敏感复发卵巢癌(N=683,30.7%)。新诊断卵巢癌和铂敏感复发性卵巢癌试验独立分析。
一、研究特征
在新诊断卵巢癌试验(FL)中,大多数患者的体能状态 (PS) 为0(N=931/1253,74.3%)、FIGO分期为III-IV期(N=1502,97.0%)、类型为高级别浆液性卵巢癌(N=1256,81.1%),且对当前化疗完全缓解 (CR)(N=1356,87.6%)。有三项试验特别标记了BRCA 突变状态,其中55.8%(N=219/421) 的患者携带胚系或体细胞突变。在这些研究中,不良事件通用术语标准 (CTCAE) 第4版的使用频率高于第3版(分别为N=885及N=417)。
在铂敏感复发性卵巢癌的试验(PSROC)中,大多数患者的体能状态 (PS) 为0(N=469,68.4%)、类型为高级别浆液性卵巢癌(N=480/505,95.0%),当前化疗的CR率为45.6%(N=313),大约有一半的患者既往接受或≥2线化疗(N=348,50.7%),60.9%(N=418)的患者无铂间期超过12个月,60.2%(N=343/570)的患者携BRCA突变。使用CTCAE 第四版的有4项试验(仅1项采用第三版)。
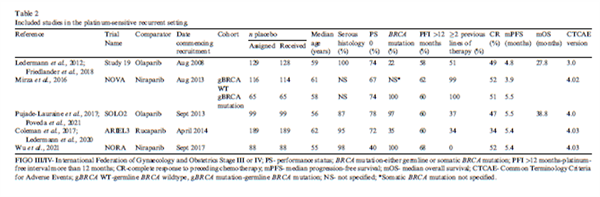
PARP抑制剂是其中七项试验的活性药物对照组,包括铂敏感复发性卵巢癌的所有五项试验。
二、AE的汇总发生率
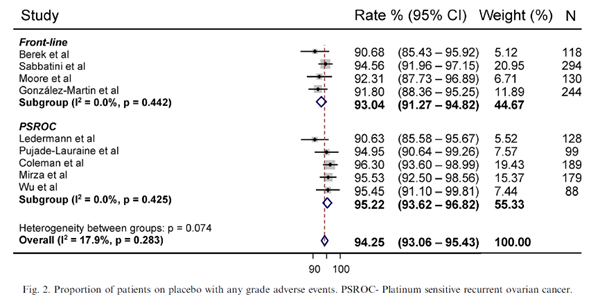
所有试验均记录了医生报告的AE。在一线维持治疗组,4项试验(786例患者)报告了接受安慰剂治疗的患者发生任何级别 AE 的比例。合并风险为93.0%( P=0.44),其中发生率为7.6%每月(图2)。任何≥3级 AE 的风险为14.6%(p<0.001),发病率为1.4%每月 (图3)。记录中有2例治疗中出现的死亡。
在683例 PSROC 患者中,95.2%(P=0.43) 发生任何级别的AE,发生率为18.6%每月 (图2)。发生任何≥3级 AE 的风险为18.2%(P=0.21),发生率为3.5%每月 (图3)。PSROC患者的≥3级AE风险显著高于一线患者 (P=0.04)。

FL 和 PSROC 中血液学和胃肠道≥3级AE 的发生率相似 (图4)。最常见的为血液学AE,FL 和 PSROC 患者中发生≥3级中性粒细胞减少症分别有1.6%和1.8%。最常见的≥3级胃肠道 AE 为腹痛,发生率分别为0.7% 和1.1%。
PARP 抑制剂的安慰剂组与其他 RCT 的安慰剂组特定的≥3级AESI (特别关注的不良事件)相似。在使用 CTCAE 第3版的 RCT 中,FL和PSROC的≥3级腹泻的发生率分别为2.4%和2.3%,而使用第4版的 RCT 分别为0.6%和0.9%。同样,在使用 CTCAE 第3版的 RCT 中,FL和 PSROC中分别有2.4%和3.1%发生≥3级疲劳,而使用 CTCAE 第4版的 RCT 中分别有0.3%和0.9%发生≥3级疲劳。
三、安慰剂组中导致给药延迟剂量降低和治疗停止的AE
FL 试验中,AE相关给药延迟的风险为14.4%(P<0 .001)、剂量降低为4.1%(P < 0.001) 和治疗停止为2.6%(P=0.002)。
PSROC试验中,AE相关给药延迟的风险为8.4%(P=0.005),剂量降低为5.5%(P <0 .001)和治疗停止2.1%(P=0.54)。FL的治疗相关给药延迟率显著更高(P=0.03),而 PSROC 中剂量降低更高 (P=0.02)。不同环境之间的治疗停止率无显著差异。
四、讨论
这项荟萃分析表明,RCT中绝大多数接受盲态安慰剂作为维持治疗的上皮性卵巢癌患者发生AE,大约六分之一的患者发生≥3级AE,导致治疗中断、剂量降低,以及罕见的治疗停止。然而,≥3级AESI的发生率仍然很低,约1%的患者发生≥3级的腹痛、恶心、呕吐、腹泻和便秘。血液学毒性的发生率略高,2%的患者发生≥3级中性粒细胞减少症。
本项荟萃分析首次量化了 AOC 维持治疗 RCT 安慰剂组的 AE 发生率。
反安慰剂现象可能在报告的 AE 中占很大比例。在我们的荟萃分析中,设盲安慰剂药物不太可能直接引起报告的AE。接受肿瘤治疗的患者似乎特别容易受到反安慰剂效应的影响,维持试验环境促进了许多驱动心理机制。其中包括收到关于可能 AE 的信息,与近期完成的化疗和其他研究中 AE 相关的负面经历以及对这些事件的预期。反安慰剂的神经生物学基础主要在镇痛环境中进行了研究。皮质激素和胆囊收缩素系统的含义强调了焦虑和反安慰剂痛觉过敏之间的重要性。虽然不同反安慰剂症状的精确神经生物学尚不清楚,但在维持治疗环境中这些系统可能受到牵连和增强。
AE 也可能继发于既往化疗的残留毒性,这可能解释了观察到的≥3级血液学毒性。约50%的 PSROC 患者既往接受过二线或二线以上化疗。PSROC试验中任何≥3级 AE 的发生率显著更高 (18.2% vs 14.6%,P=0.04),AE相关剂量降低的发生率也显著更高 (5.5%vs 2.6%,P=0.02)。
报告方法也可以解释安慰剂组采集的一些AE,因为 RCT 使用 CTCAE 第3版而不是第4版的某些 AESI 的发生率更高。
该研究的局限性在于虽然显示大量患者发生任何≥3级AE,但无法获得个体患者数据,因此无法对不同但相关的 AE 进行聚类,评价 AE 的发生时间、持续时间、复发或联合用药的影响。无法确定 AE 发生与癌症复发或进展或既往治疗之间的相关性。无法探索按年龄、PS、心理共病和其他可能影响反安慰剂现象的因素进行的亚组分析。此外,医生 AE 评估和报告是单侧的,医生和患者报告的肿瘤 AE 可能不一致。
尽管存在这些局限性,这项研究结果仍具有一些意义。该研究量化了在维持治疗环境中接受安慰剂治疗的 AOC 患者的AE“基线”率,这是未来评价新型治疗的单组研究的重要基准。此外,该荟萃分析表明,当前评估和报告 AE 的方法不一定反映试验用治疗药物所致AE,尤其是总体任何级别AE。即使是总体≥3级 AE 和 AE 相关治疗延迟和剂量降低,其归因于治疗的可能性也有限。
总之,在维持 RCT 中接受盲态安慰剂治疗的 AOC 患者AE 发生率较高,导致给药中断、剂量减少,并且在较小程度上导致安慰剂停药。目前在 RCT 中评估和报告 AE 的方法并不一定反映真正归因于试验性治疗药物的AE。
点评
■ 从这篇研究中,我们可以看到,在卵巢癌中,并非所有浸润T细胞均能发挥抗肿瘤活性。只有占比仅13%的TRM细胞是有效的浸润T细胞。这提示我们,在卵巢癌这样的免疫治疗效果欠佳的肿瘤中,仅对CD8+ T细胞的浸润情况进行检测,还不足以准确判断肿瘤的免疫原性。
■TRM细胞表现为CD103/CD69/EpCAM阳性,可以通过多重荧光免疫检测来识别,临床可及性较高。因此TRM-TIL可能是下一步免疫治疗临床研究的潜在Biomarker。

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
