鉴于近两年新冠在全球范围内大流行,对癌症患者、亲属和护理人员产生了重大影响,本期OC文献精读特邀中山大学肿瘤防治中心的蓝春燕教授,与大家分享一篇有关卵巢癌患者接受PARPi治疗期间接种新冠疫苗是否会影响的疫苗效价的文章。该文章于2021年10月发表在Vaccines杂志上。


 00:000:00 音频
00:000:00 音频 一、研究背景
癌症是全球范围内的重大公共卫生问题。据估计,2020年新发癌症病例接近2000万,癌症死亡人数达到1000万[1],由严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)引起的COVID-19大流行,在全世界产生了前所未有的影响。COVID-19患者主要表现为来自呼吸系统的症状,但其他器官也可能受累。疾病的严重程度各不相同,从完全无症状的携带者到SARS-CoV-2感染引起的严重呼吸衰竭和多种并发症导致多器官衰竭和死亡的患者[2]。有几项回顾性分析显示,癌症患者更容易感染COVID-19 [3],癌症也增加了COVID-19患者的死亡率,同时,因为疫情防护的限制,部分癌症患者接受的治疗(包括手术治疗、放疗和化疗)、及定期随访等也都出现过延迟。因此,在大多数国家,癌症患者一直是疫苗接种策略的关键目标群体,并在包括希腊在内的几个国家优先接受COVID-19疫苗接种。然而,新冠疫苗注册的临床试验入组人群排除了癌症患者,缺乏该人群接种疫苗的安全性和有效性数据 [5,6]。
PARPi通过抑制PARP酶的活性并捕获DNA上的PARP蛋白,导致癌细胞死亡 [7]。PARPi改变了许多常见癌症类型的管理。这些药物目前用于卵巢癌患者,作为新诊断或复发性疾病化疗完成后的维持治疗。临床前研究还表明,这些药物可能具有免疫调节作用,可调节固有和适应性免疫系统 [9]。从这个角度出发,我们进行了一项大型前瞻性研究(NCT04743388),入组了实体瘤和血液恶性肿瘤患者以及健康志愿者,以研究COVID-19接种后抗SARS-CoV-2 抗体的动力学 [10]。在此,我们报告了接受PARPi的实体瘤患者在接种BNT162b2、AZD1222或mRNA-1273疫苗后产生抗SARS-CoV-2的中和抗体(NAb)的水平。
二、材料和方法
在前瞻性研究NCT04743388中,我们纳入了癌症患者和健康志愿者,以研究接种COVID-19疫苗后抗SARS-CoV-2 抗体的动力学。接受PARPi治疗的患者队列的主要入选标准包括:
■ 年龄超过18岁
■ 组织学确诊并接受PARPi治疗的卵巢癌/乳腺癌/前列腺癌/胰腺癌,不考虑治疗阶段;
■ 疫苗接种资格
在接种前第1天、接种后第22天和第二针接种后1个月采集患者和对照组的血液。使用FDA批准的方法(ELISA,cPassSARS-CoV-2?NAb检测试剂盒;GenScript,Piscataway,NJ,USA) [11]测定抗SARS-CoV-2的 NAb。在同一 ELISA板中测定同一患者或对照的样本。本研究获得了相应伦理委员会的批准(决定编号15/23-12-2020),符合赫尔辛基宣言和人用药品注册技术要求国际协调会药物临床试验质量管理规范。所有患者和对照在入组研究前均提供了书面知情同意书。所有数据均可根据作者的要求提供。
三、结果
研究人群包括 36 例卵巢癌患者(均为女性;中位年龄:64岁,IQR:51-72岁)和160例对照志愿者(均为女性;中位年龄:63 岁,IQR:60-78岁),在同一时期接种疫苗。在研究中,36例患者中的30例(83.3%)和130/160例对照(81.2%)接种了mRNA疫苗(BNT162b2和mRNA-1273),而6/36例患者(16.7%)和30/160例对照(18.8%)接种了AZD1222 疫苗(p=0.13)。所有研究受试者都接受2剂指定分配的疫苗。患者的中位BMI(重度COVID-19疾病的主要风险因素)为25.8m2/kg(IQR:23-30),对照组为26m2/kg/kg(IQR:23-29)(p = 0.44)。
患者组均为卵巢癌患者,最常见的合并症包括心血管疾病(44%)、代谢紊乱(31%)和肺部疾病(8%)。都接受过PARPi治疗,中位治疗时间为4个月(范围1-17)。其中20例患者(55.5%)接受了奥拉帕利治疗,15例患者(42%)接受了尼拉帕利治疗,1例患者接受了rucaparib 治疗。
接种前第1天,患者和对照组之间的NAb滴度无差异(p= 0.44)。既往均无已知COVID-19感染史。首次接种后第22天,与对照组相比,患者的NAb滴度较低:患者的中位NAb抑制滴度为20.0%(IQR:5.5-31.9%),对照组为42.5%(IQR:28.1-58.7%)(p<0.001)(图 1)。更具体地说,在第22天,与119例对照(74.4%)相比,仅10例患者(27.8%)NAb滴度≥30%(p<0.001)。此外,NAb滴度≥50%的患者和对照组数量分别为2例(5.6%)和57例(35.6%)(p<0.001)。
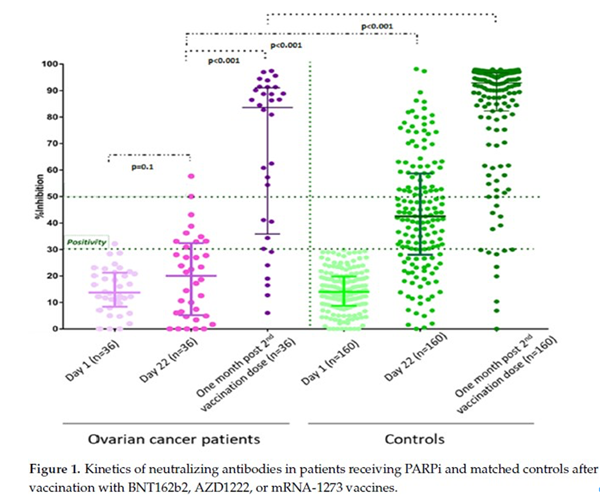
图1:接种BNT162b2、AZD1222或mRNA-1273疫苗后,接受PARPi的患者和匹配的对照组中和抗体的动力学。
接种第二针疫苗后1个月,与对照组相比,患者的NAb滴度持续较低:患者的中位NAb抑制滴度为83.6%(IQR:37.4-90.7%),对照组为92.9%(IQR:82.4-96.6%)(p<0.001)(图1)。在该时间点,30例患者(83.3%)和150例对照(93.8%)对NAb滴度≥30%(p=0.039)。此外,NAb滴度≥50%的患者和对照组百分比分别为72.2%和89.4%(p=0.007)。在患者组中,未观察到 PARPi治疗持续时间与NAb抑制滴度之间存在显著相互作用(p=0.400),无需更改患者的肿瘤治疗计划。此外,接种疫苗后,未发现PARPi相关不良事件发生率增加。关于安全性,在接受PARPi治疗的36例癌症患者中未观察到非预期或重度不良事件。疫苗接种引起的最常见不良事件为注射部位疼痛(22.2%)、发热(14%)和疲乏(12%)。
四、讨论
COVID-19大流行对癌症患者、亲属和护理人员提出了重大挑战 [12]。观察性研究表明,平衡接受治疗时COVID-19感染风险的增加或推迟治疗时疾病进展风险的增加会加重癌症患者的抑郁和焦虑 [13]。据我们所知,我们在此首次介绍了接受PARPi的患者接种COVID-19疫苗的有效性结果。与健康对照组相比,接受PARPi治疗并接受BNT162b2、AZD1222或mRNA-1273疫苗的患者在第二次接种疫苗后长达1个月内产生了较低滴度的抗SARS-CoV-2 NAb。在癌症患者中,年龄、基础疾病和免疫抑制剂给药(包括化疗和皮质类固醇)等因素也可减弱免疫应答 [14]。卵巢癌患者在疾病经化疗缓解后接受PARPi维持治疗。此外,这些患者很少接受免疫抑制剂。从这个角度来看,在我们接受PARPi治疗的患者中记录的抗COVID-19疫苗接种的减毒免疫应答,至少在疫苗接种完成后1个月,是值得关注的。应注意的是,在实验模型中,PARPi通过各种机制对SARS-CoV-2感染发挥有益作用 [15],包括减弱SARS-CoV-2诱导的炎症反应和细胞因子风暴以及减少肺纤维化,这是SARS-CoV-2感染的常见结果。因此,最近有人建议再利用这些药物来治疗COVID-19 [16]。此外,PARP抑制被认为可影响免疫细胞。有证据表明PARP参与T细胞成熟和分化。PARP抑制还可能在维持B细胞稳态、分化和抗体生成中发挥作用,同时还会对树突状细胞的成熟和抗原呈递功能产生负面影响 [17]。因此,正如我们的发现所提示的,PARPi是否也能减弱对疫苗接种的免疫反应,值得进一步评价。当地监管机构应考虑这些数据,优先考虑这些患者的第三次接种剂量。我们的结果与Monin等人的研究一致。Terpos等人报告癌症患者单次接种疫苗的有效性较差 [18,19]。最近,Waissengrin等。报告了 BNT162b2疫苗在接受免疫检查点抑制剂(ICI)治疗的癌症患者中的安全性结果 [20]。在我们的研究人群中也证实了这些数据;在我们科室的36例在PARPi治疗期间接受疫苗接种的患者中,未观察到非预期不良事件。鉴于目前COVID大流行的特殊情况,癌症患者在等待更大规模、前瞻性试验的同时,不应落后于全球的疫苗接种活动。在任何情况下,这些结果表明,即使在疫苗接种完成后,保持COVID-19预防措施对癌症患者也至关重要。出现增加传播性和抑制抗体中和效力的新病毒变体是目前现有疫苗接种计划的重大挑战。这些变异株可能对疫苗接种效果产生负面影响 [21]。在这种情况下,我们的数据还表明,在一定时间后给予第三剂可能是有益的,以便为该组患者产生最佳的免疫力。这符合希腊以及世界其他国家的现行指南,这些指南提出了包括癌症患者在内的易感患者的第三次疫苗接种剂量。从这个角度来看,继续重新评估疫苗对SARS-CoV-2新变体的有效性是很重要的,同时,我们的研究人群正在进行进一步的随访,这将为癌症患者疫苗接种的有效性提供综合数据。总之,我们的数据表明,在完成疫苗接种项目后,与健康对照组相比,接受 PARPi治疗的卵巢癌患者的SARS-CoV-2中和抗体在统计学上较低。但是本研究缺少未接受PARPi治疗的卵巢癌患者接种疫苗后的SARS-CoV-2中和抗体数据,设计不够严谨,不能说明PARPi的使用会降低接种疫苗产生的抗体滴度。
参考文献:
1.Sung, H.; Ferlay, J.; Siegel, R.L.; Laversanne, M.; Soerjomataram, I.; Jemal, A.; Bray,F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA. Cancer J. Clin. 2021, 71, 209–249.
2.Yuki, K.; Fujiogi, M.; Koutsogiannaki, S. COVID-19 pathophysiology: A review. Clin. Immunol. 2020, 215, 108427.
3.Rodriguez, G.M.; Ferguson, J.M.; Kurian, A.; Bondy, M.; Patel, M.I. The Impact of COVID-19 on Patients with Cancer: A National Study of Patient Experiences. Am. J. Clin. Oncol. 2021
4.Yang, L.; Chai, P.; Yu, J.; Fan, X. Effects of cancer on patients with COVID-19: A systematic review and meta-analysis of 63,019 participants. Cancer Biol. Med. 2021, 18, 298–307.
5.Polack, F.P.; Thomas, S.J.; Kitchin, N.; Absalon, J.; Gurtman, A.; Lockhart, S.; Perez, J.L.; Pérez Marc, G.; Moreira, E.D.; Zerbini, C.; et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N. Engl. J. Med. 2020, 383, 2603–2615.
6.Voysey, M.; Clemens, S.A.C.; Madhi, S.A.; Weckx, L.Y.; Folegatti, P.M.; Aley, P.K.; Angus, B.; Baillie, V.L.; Barnabas, S.L.; Bhorat, Q.E.; et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: An interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet 2021, 397, 99–111.
7.Yi, M.; Dong, B.; Qin, S.; Chu, Q.; Wu, K.; Luo, S. Advances and perspectives of PARP inhibitors. Exp. Hematol. Oncol. 2019, 8, 29.
8.Mateo, J.; Lord, C.J.; Serra, V.; Tutt, A.; Balma?a, J.; Castroviejo-Bermejo, M.; Cruz, C.; Oaknin, A.; Kaye, S.B.; de Bono, J.S. A decade of clinical development of PARP inhibitors in perspective. Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 2019, 30, 1437– 1447.
9.Yélamos, J.; Moreno-Lama, L.; Jimeno, J.; Ali, S.O. Immunomodulatory Roles of PARP-1 and PARP-2: Impact on PARP-Centered Cancer Therapies. Cancers 2020, 12, 392.
10.Terpos, E.; Trougakos, I.P.; Apostolakou, F.; Charitaki, I.; Sklirou, A.D.; Mavrianou, N.; Papanagnou, E.-D.; Liacos, C.-I.; Gumeni, S.; Rentziou, G.; et al. Age- dependent and gender-dependent antibody responses against SARS-CoV-2 in health workers and octogenarians after vaccination with the BNT162b2 mRNA vaccine. Am. J. Hematol. 2021, 96, E257–E259.
11.Tan, C.W.; Chia, W.N.; Qin, X.; Liu, P.; Chen, M.I.-C.; Tiu, C.; Hu, Z.; Chen, V.C.-W.; Young, B.E.; Sia, W.R.; et al. A SARSCoV-
2 surrogate virus neutralization test based on antibody-mediated blockage of ACE2-spike protein-protein interaction. Nat. Biotechnol. 2020, 38, 1073–1078.
12.Mitra, M.; Basu, M. A Study on Challenges to Health Care Delivery Faced by Cancer Patients in India During the COVID-19 Pandemic. J. Prim. Care Community Health 2020, 11, 2150132720942705.
13.Ayubi, E.; Bashirian, S.; Khazaei, S. Depression and Anxiety Among Patients with Cancer During COVID-19 Pandemic: A Systematic Review and Meta-analysis. J. Gastrointest. Cancer 2021, 52, 499–507.
14.Hiam-Galvez, K.J.; Allen, B.M.; Spitzer, M.H. Systemic immunity in cancer. Nat. Rev. Cancer 2021, 21, 345–359.
15.Curtin, N.; Bányai, K.; Thaventhiran, J.; Le Quesne, J.; Helyes, Z.; Bai,P. Repositioning PARP inhibitors for SARS-CoV-2 infection (COVID-19); a new multi- pronged therapy for acute respiratory distress syndrome? Br. J. Pharmacol. 2020, 177, 3635.
16.Capoluongo, E. PARP-inhibitors in a non-oncological indication as COVID-19: Are we aware about its potential role as antithrombotic drugs? The discussion is open. Biomed. Pharmacother. 2020, 130, 110536.
17.Lee, E.K.; Konstantinopoulos, P.A. PARP inhibition and immune modulation: Scientific rationale and perspectives for the treatment of gynecologic cancers. Ther. Adv. Med. Oncol. 2020, 12, 1758835920944116.
18.Monin, L.; Laing, A.G.; Mu?oz-Ruiz, M.; McKenzie, D.R.; Del Molino Del Barrio, I.; Alaguthurai, T.; Domingo-Vila, C.; Hayday, T.S.; Graham, C.; Seow, J.; et al. Safety and immunogenicity of one versus two doses of the COVID-19 vaccine BNT162b2 for patients with cancer: Interim analysis of a prospective observational study. Lancet. Oncol. 2021, 22, 765–778.
19.Terpos, E.; Zagouri, F.; Liontos, M.; Sklirou, A.D.; Koutsoukos, K.; Markellos, C.; Briasoulis, A.; Papanagnou, E.-D.; Trougakos, I.P.; Dimopoulos, M.-A. Low titers of SARS-CoV-2 neutralizing antibodies after first vaccination dose in cancer patients receiving checkpoint inhibitors. J. Hematol. Oncol. 2020, 14, 86.
20.Waissengrin, B.; Agbarya, A.; Safadi, E.; Padova, H.; Wolf, I. Short-term safety of the BNT162b2 mRNA COVID-19 vaccine in patients with cancer treated with immune checkpoint inhibitors. Lancet. Oncol. 2021, 22, 581–583.
21.Krause, P.R.; Fleming, T.R.; Longini, I.M.; Peto, R.; Briand, S.; Heymann, D.L.; Beral, V.; Snape, M.D.; Rees, H.; Ropero, A.-M.; et al. SARS-CoV-2 Variants and Vaccines. N. Engl. J. Med. 2021, 385, 179–186.

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
