本期OC文献精读邀请到上海市东方医院程静新教授,分享一篇于2021年12月发表在Seminars in Cancer Biology杂志(IF 15.707)上的综述——《Challenges for immunotherapy for the treatment of platinum resistant ovarian cancer》。在这篇文章中,作者总结了铂耐药卵巢癌免疫治疗的生物学原理和现有的临床数据,并讨论了该领域面临的挑战和未来的研究方向。


 00:000:00 音频
00:000:00 音频 一、铂耐药卵巢癌的肿瘤微环境概述
目前关于铂耐药卵巢癌肿瘤免疫微环境的数据较少,铂耐药卵巢癌作为一种“冷肿瘤”(Cold Tumor),以CD8+ T细胞和活化CD4+ T细胞低浸润、PD-L1+细胞浸润增加、调节性T细胞(Regulatory T cells, Treg)浸润增加为特征。
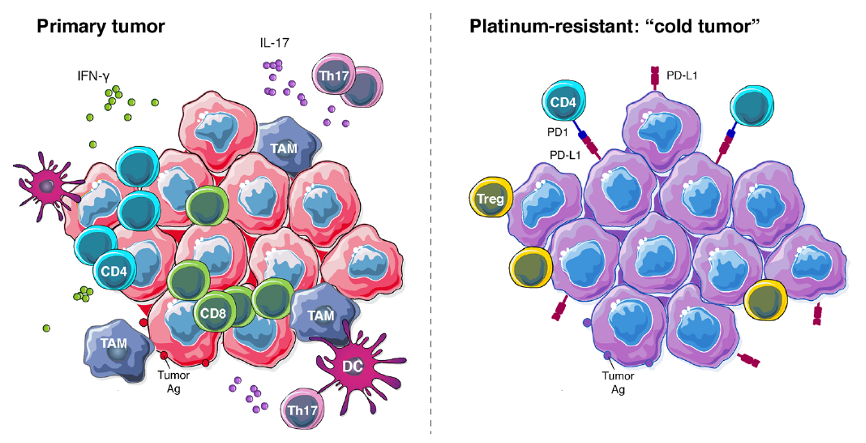
图1. 铂耐药卵巢癌的肿瘤微环境“冷”
二、免疫检查点抑制剂治疗铂耐药卵巢癌
免疫检查点抑制剂(Immune Checkpoint Inhibitors, ICI)单药
尽管上皮性卵巢癌(Epithelial ovarian cancer, EOC)被证明具有免疫原性,但迄今为止尚无免疫治疗获批。
免疫单药治疗铂耐药卵巢癌的疗效并不尽如人意,这可能和铂耐药卵巢癌“冷肿瘤”的免疫特征有关。因此,ICI治疗铂耐药卵巢癌面临的主要挑战是将“冷”肿瘤“发炎”,通过有利于功能性细胞毒性T细胞的浸润,变为“热”肿瘤;第二个挑战是如何识别预测疗效的生物标志物,例如组织学亚型、PD-L1的表达和空间分布、基因组改变等;第三个挑战是肿瘤异质性。目前越来越多的研究集中在PD1/PD-L1抑制剂的各种联合治疗,包括联合化疗释放癌症抗原、联合抗血管生成药物增加T细胞进入肿瘤、联合CTLA-4抑制剂改善淋巴结效应T细胞的启动和活化、联合DNA损伤剂,如激活I型干扰素(IFN)应答的PARP抑制剂(图2),或联合增强新抗原T细胞反应性的疫苗。
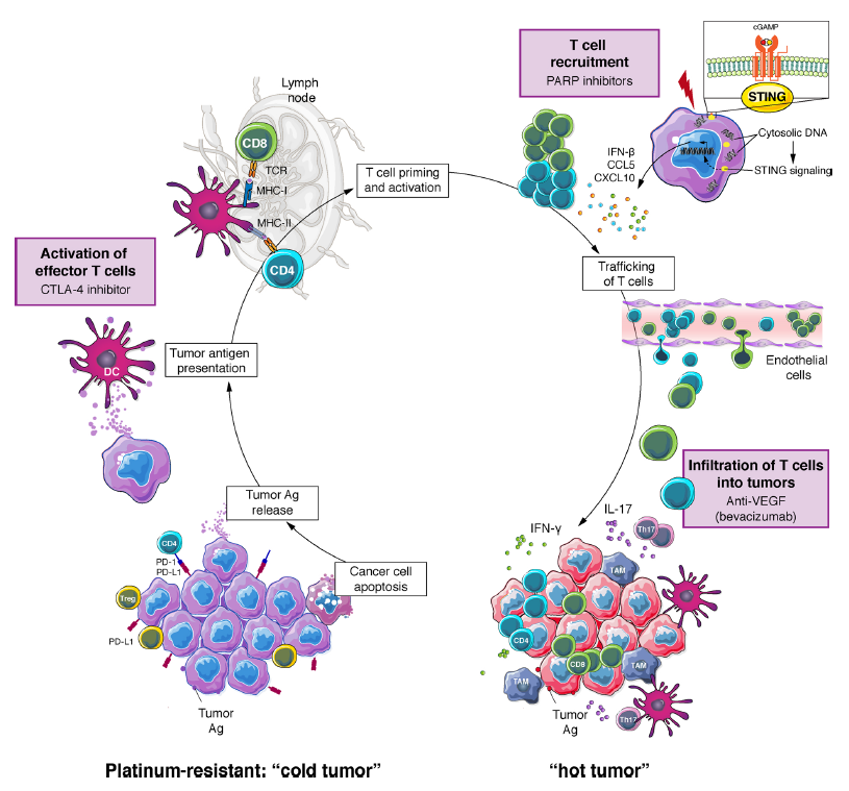
图2. 将铂耐药卵巢癌肿瘤微环境由“冷”变“热”的不同治疗策略
PD1/PD-L1抑制剂联合化疗
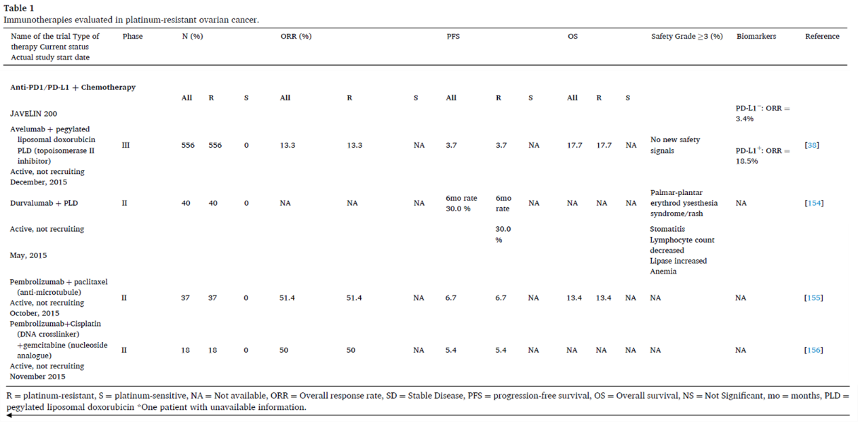
PD1/PD-L1抑制剂联合抗血管生成药物
血管内皮生长因子介导的免疫抑制机制主要从3个方面出发:1)抑制树突状细胞成熟;2)减少T细胞对肿瘤的浸润;3)促进肿瘤微环境中的免疫抑制细胞(Treg和髓源性抑制细胞)。
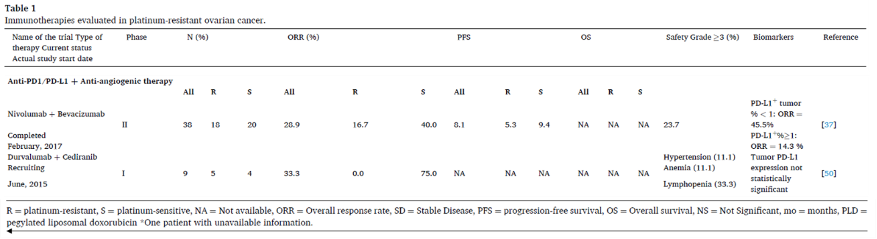
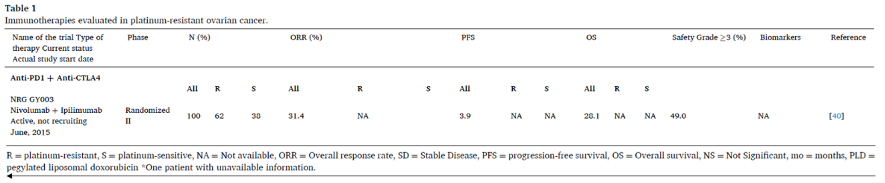
PD1抑制剂联合CTLA-4抑制剂
PD1在慢性抗原呈递中主要表达于肿瘤内的CD8+ T细胞上,导致T细胞恶化,称为“耗竭”(Exhaustion),而CTLA-4是在抗原呈递后早期表达于T细胞上,抑制免疫应答的启动阶段。
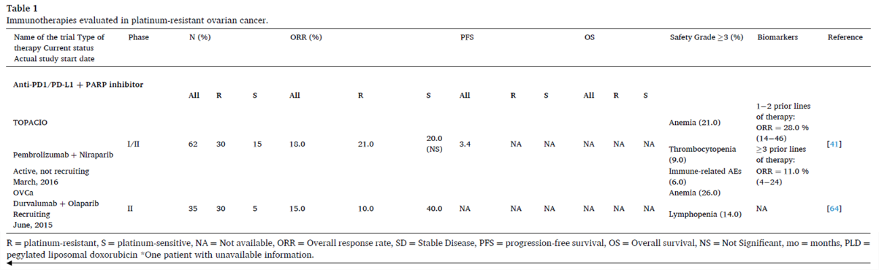
PD1/PD-L1抑制剂联合PARP抑制剂
ICI和PARP抑制剂联用在高级别浆液性卵巢癌(HGSOC)中已有很强的生物学依据。PARP抑制剂加剧了肿瘤细胞胞质DNA的释放,进而激活DNA感应环GMP-AMP合成酶-干扰素基因刺激物(cGAS-STING),这是一种参与先天性免疫应答的通路。cGAS-STING通路的激活可刺激癌细胞产生IFN,并上调促炎趋化因子CCL5和CXCL10的表达,这些因子可募集CD8 + T细胞进入肿瘤(图2)。PARP抑制剂可激活树突状细胞中的cGAS-STING通路,刺激抗原呈递和肿瘤内进一步募集T细胞。同时,PARP抑制剂会上调肿瘤细胞PD-L1的表达。在BRCA野生型卵巢癌中,PARP抑制剂与PD1抑制剂具有协同作用也得到了验证。
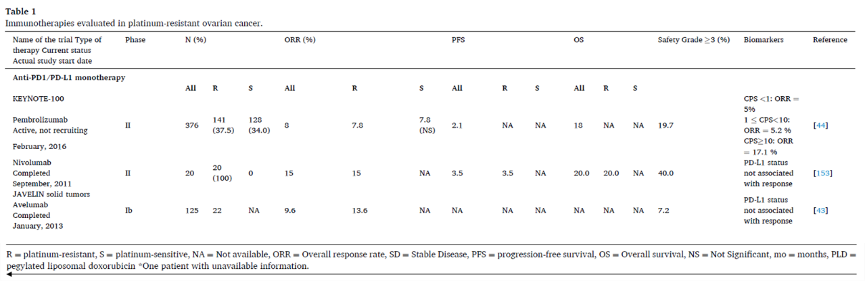
TOPACIO研究是一项评估帕博利珠单抗联合尼拉帕利治疗复发性上皮性卵巢癌的I/II期临床试验,无论BRCA突变状态如何,铂耐药亚组客观缓解率为21%(90%CI: 9%-37%)。另一项II期试验评估了PD-L1抑制剂度伐利尤单抗联合奥拉帕利治疗复发性上皮性卵巢癌的疗效和安全性,其中大多数患者(30/35, 86%)为铂耐药患者,整体人群ORR为15%。所有8例缓解者在治疗前活检中均有免疫反应性标记,而非缓解者没有免疫反应性标记,说明PARP抑制剂和PD-L1抑制剂联合治疗的挑战可能是不足以诱导“冷”肿瘤缓解。
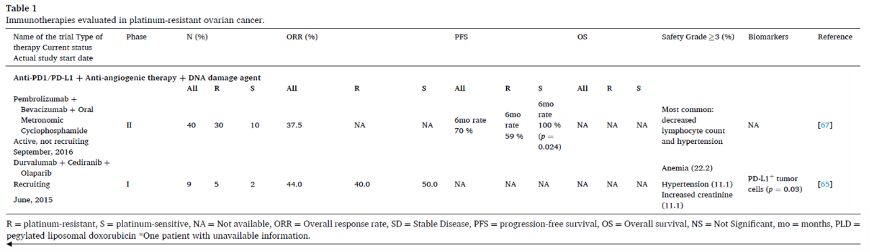
PD1/PD-L1抑制剂+抗血管生成药物+DNA损伤剂
度伐利尤单抗联合西地尼布和奥拉帕利的一项I期研究显示了初步结果。另一种三联治疗组合是帕博利珠单抗+贝伐珠单抗+口服环磷酰胺节拍治疗复发性EOC,ORR为37.5%,40例患者中30例为铂耐药。联合环磷酰胺的原理是其免疫调节作用,既往研究显示,环磷酰胺可通过降低循环中Treg的数量、恢复T和NK效应功能、促进I型干扰素和影响树突状细胞稳态来降低免疫耐受。
三、卵巢透明细胞癌可能是ICI的一个优选靶点
卵巢透明细胞癌占上皮性卵巢癌的10%, PD-L1在20%~40%以上的卵巢透明细胞癌中高表达。III期卵巢透明细胞癌患者中位OS不超过两年。几项临床试验显示卵巢透明细胞癌对ICI敏感性增加:
■ 纳武单抗II期试验:20例完全缓解(CR)的铂耐药卵巢癌患者中的2例为透明细胞癌;
■ KEYNOTE-100研究:入组376例复发性EOC,19例为透明细胞癌。透明细胞癌的缓解率为15.8%(95%CI: 3.4%-39.6%),HGSOC为8.5%(95%CI: 5.5%-12.4%);
■ NRG GY003 II期试验:伊匹木单抗+纳武单抗治疗v.s.纳武单抗单药,与其他亚型(n=88)相比,卵巢透明细胞癌患者(n=12)缓解率约为5倍(OR = 5.21; 95%CI: 1.37-19.77)。
虽然这些证据受到患者数量的限制,但表明卵巢透明细胞癌对ICI的敏感性增加,需要在更大型的试验中进一步研究。
四、肿瘤疫苗
疫苗治疗旨在通过提供肿瘤相关抗原和激活信号来刺激内源性肿瘤特异性T细胞。肿瘤疫苗主要面临两个挑战:
1) 鉴定正确的抗原、合适的免疫佐剂和递送方法;
2) 免疫抑制肿瘤微环境损害了有效的抗肿瘤反应。
铂耐药卵巢癌最有希望的疫苗方法可能是开发单独突变的新抗原疫苗。未来铂耐药卵巢癌疫苗治疗成功必须将个性化疫苗与免疫调节相结合。
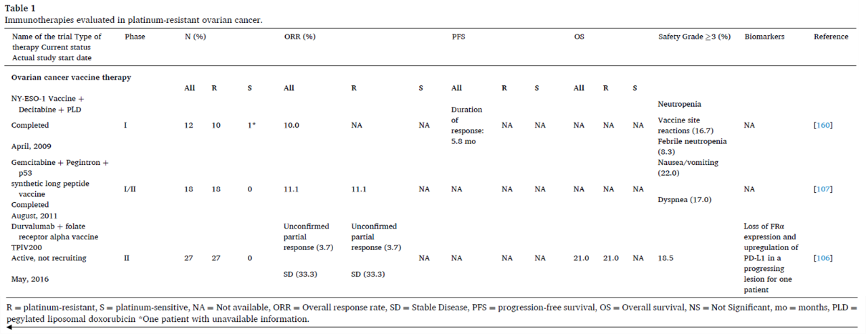
五、通过T细胞治疗
过继性T细胞(Adoptive T cell, ACT)治疗是通过被动转移大量能够立即发挥效应功能的肿瘤反应性T细胞,来消除大多数肿瘤细胞。ACT有两种主要形式:分离的肿瘤浸润淋巴细胞(TILs)扩增,或表达特异性TCR或嵌合抗原受体的基因修饰T细胞(从外周血中采集)。两种方法均在铂耐药卵巢癌中进行了研究,但活性有限。
自体肿瘤浸润淋巴细胞治疗
基于自体TILs的ACT治疗允许激活和扩增肿瘤反应性T细胞,用于随后输注至淋巴细胞耗竭的自体宿主。TILs治疗实体瘤的主要挑战是产生足够数量的高活性抗肿瘤T细胞,并且具有适当的效应功能,使其在体内能杀死癌细胞;另一个挑战是慢性抗原刺激导致的T细胞耗竭。
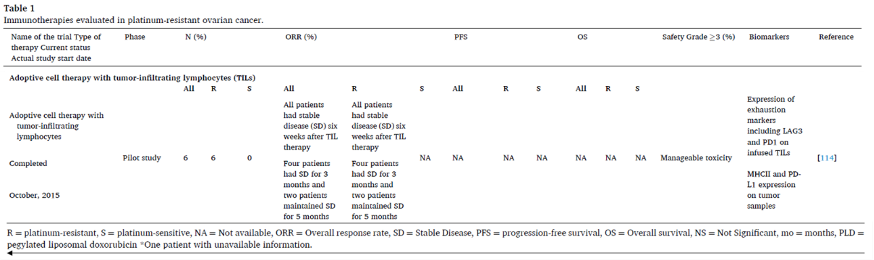
嵌合抗原受体T细胞(CAR-T)
虽然CAR-T在B细胞恶性肿瘤中取得了一定成功,但目前CAR-T细胞在实体瘤中的表现出的活性有限。间皮素是卵巢癌CAR-T治疗最有前景的肿瘤相关抗原(Tumor-associated antigen, TAA)候选药物之一,是一种细胞表面蛋白,在HGSOC中过表达,而在浆膜细胞低表达。CAR-T治疗实体瘤,包括铂耐药卵巢癌面临着几项挑战:1)TAA(这里指间皮素)的表达具有异质性;2)间皮素抑制剂CAR-T细胞的扩增比之前报道的抗CD19 CAR-T细胞低10倍,输注后28天,大部分患者的外周血中检测不到间皮素;3)肿瘤内检测到的CAR-T细胞水平低,提示浸润不良、肿瘤内缺乏扩增。为了克服CAR-T细胞进入肿瘤的障碍,目前有研究表明,CAR-T细胞通过腹腔镜的局部给药在铂耐药卵巢癌中是可行的。
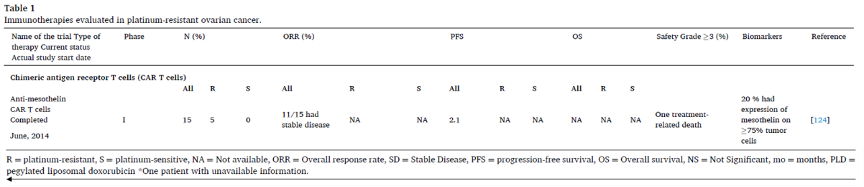
T细胞受体工程T细胞
T细胞受体(T cell receptor,TCR)工程T细胞与CAR-T细胞不同,CAR-T细胞依赖于抗体样介导的抗原结合,与人类白细胞抗原(Human leukocyte antigen,HLA)呈递无关,但基于TCR的过继性T细胞是为成熟T细胞提供高亲和力的TCR,在癌细胞识别I类HLA分子的背景下识别呈递的肿瘤相关抗原表位。T细胞受体工程T细胞治疗的主要挑战是TAA的选择。在铂耐药卵巢癌背景下进行的大多数研究都针对“共享”TAA改造了TCR,但尚未有研究在铂耐药卵巢癌中观察到客观缓解。
除此之外,TCR工程T细胞对HLA结合抗原具有依赖性,而I类HLA表达频繁异常,且癌细胞破坏了抗原呈递机制,这成为了TCR工程T细胞治疗卵巢癌的最大挑战。
六、靶向髓系免疫检查点
CD47是一种在多种类型肿瘤表面过表达的跨膜蛋白,最初被确定为“别吃我”信号,因为它与吞噬免疫细胞上表达的信号调节蛋白α(SIRPα)形成信号复合物,使癌细胞能够逃避巨噬细胞介导的吞噬作用。CD47在大多数EOC中过表达。最近一项I期研究纳入了13例EOC患者,其中2例观察到客观缓解,这一结果值得进一步在II期研究中证实。
七、专家点评
铂耐药卵巢癌是一种异质性疾病,涉及多种生物学机制,例如肿瘤干细胞、miRNA、细胞周期蛋白E基因(CCNE1)扩增、恢复BRCA1/2基因开放阅读框的回复突变、BRCA1启动子甲基化缺失、与药物外排泵MDR1基因过表达相关的复发性启动子融合。尽管上皮性卵巢癌被证明具有免疫原性,但迄今为止尚无免疫治疗获批。ICI单药治疗铂耐药卵巢癌疗效有限,越来越多的研究转向联合治疗的方向。对于铂耐药卵巢癌的免疫治疗,我们需要更好地描述肿瘤的免疫特征以及基因组,寻找将这种“冷”肿瘤转化为“热”肿瘤的最佳策略。

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
