卵巢癌是致死率最高的妇科恶性肿瘤,较强的隐匿性、早期诊断困难和化疗耐药等原因,使卵巢癌的5年生存率低于48%,目前卵巢癌的临床治疗中,迫切需要传统化疗以外的新型或联合策略。
PARP抑制剂的问世,为卵巢癌患者的治疗带来了显著而持久的抗肿瘤疗效,而与其他药物联合使用的探索,可能是PARP抑制剂增强疗效和克服耐药的新途径。有研究发现,尼拉帕利在卵巢癌治疗中与免疫检查点抑制剂具有协同效应,阐明细胞毒性抗癌药物和癌症相关免疫之间的关联,可能会发现更有效的组合策略,为卵巢癌治疗带来新希望。
今天邀请到了河南省肿瘤医院-妇瘤科-陈红敏教授解读于2021年10月发表在Journal of Translational Medicine的一篇题为《尼拉帕利通过诱导卵巢癌的免疫应答与PD-L1抑制剂产生协同抗肿瘤作用》的文章。


 00:000:00 音频
00:000:00 音频 该文章探索了尼拉帕利治疗期间,免疫细胞和细胞因子的动态变化和应答,研究显示尼拉帕利可通过激活cGAS/STING通路调节免疫应答,联合程序性细胞死亡配体1(PD-L1)抑制剂可进一步增强这一作用,这些结果为临床治疗提供了良好的理论依据。
一、研究背景
免疫检查点抑制(ICB)疗法的应用前景广阔,越来越多的证据表明,传统和靶向治疗可以影响肿瘤相关的免疫反应,并提高免疫治疗的有效性。研究显示,这些药物的应答与致突变负荷有关,例如在携带BRCA和其他同源重组(HR)蛋白缺陷的肿瘤中的体现。此外,在临床前模型和临床试验中,已报告PARP抑制剂与PD-L1抑制剂产生协同效应。
二、研究方法
研究中,通过蛋白免疫印迹法(WB)和流式细胞术,检测PARP抑制剂处理后人卵巢癌细胞中PD-L1的表达;采用免疫组化(IHC)法检测人卵巢癌组织中多聚ADP核糖聚合酶(PARP1)、PD-L1、CD8的表达;体内研究尼拉帕利和PD-L1抑制剂对卵巢癌进展的影响;采用流式细胞术和酶联免疫吸附试验(ELISA)检测体内外免疫细胞和细胞因子的变化;采用WB、ELISA法测定尼拉帕利治疗后cGAS/STING信号通路的变化。
三、研究结果
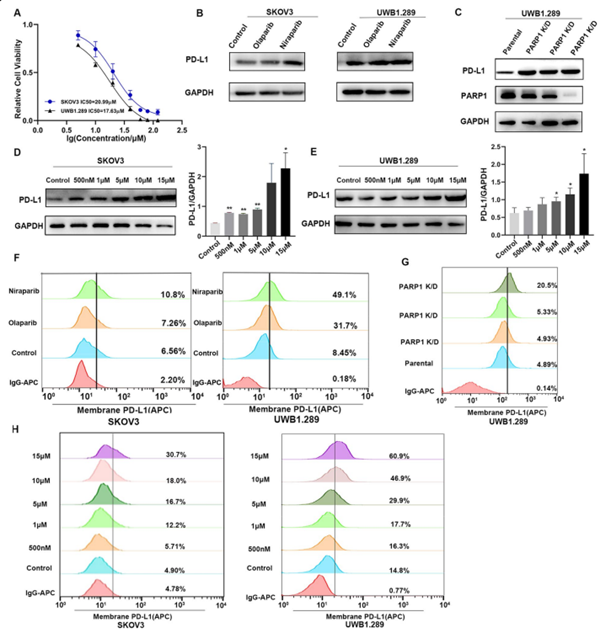
PARP抑制剂在体外上调卵巢癌细胞PD-L1表达
研究结果证明肿瘤细胞中PD-L1表达增加可增强PD-L1/PD-1轴介导的抗癌免疫抑制作用。
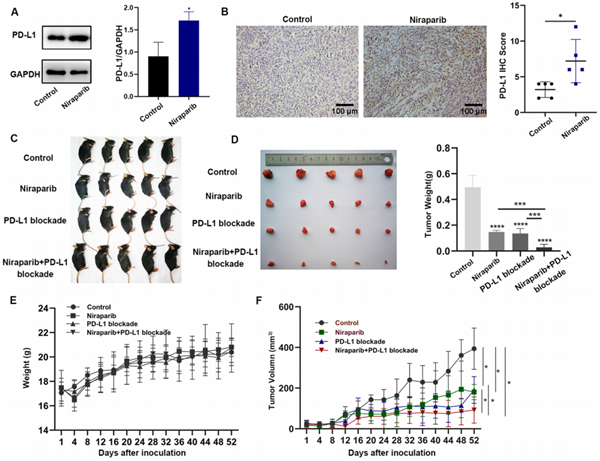
尼拉帕利可在体内上调卵巢癌的PD-L1表达,并与PD-L1抑制剂具有协同效应
在小鼠中研究PARP抑制剂尼拉帕利联合PD-L1抑制剂的作用,虽然尼拉帕利单药可以抑制肿瘤生长,但与PD-L1抑制剂联合治疗与单药治疗相比,抑制肿瘤生长更有效;此外,小鼠体重曲线无明显差异,说明尼拉帕利联合PD-L1抑制剂的不良反应较小。
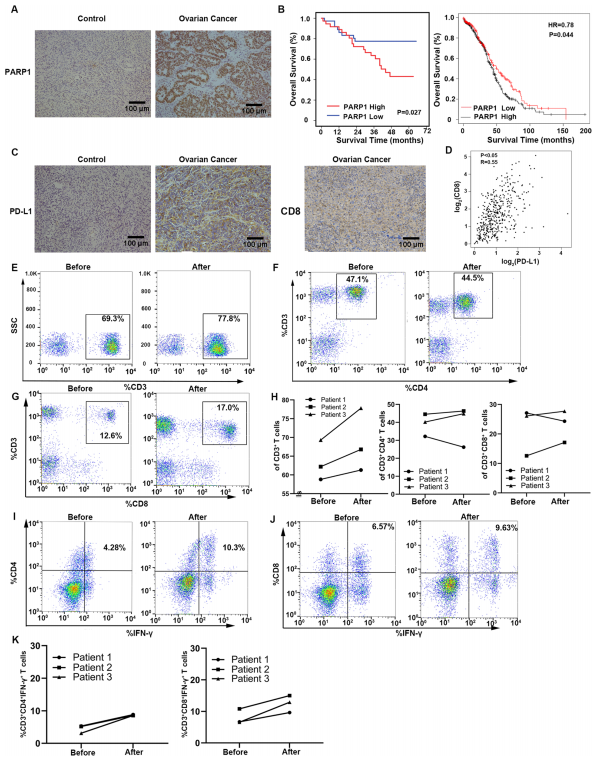
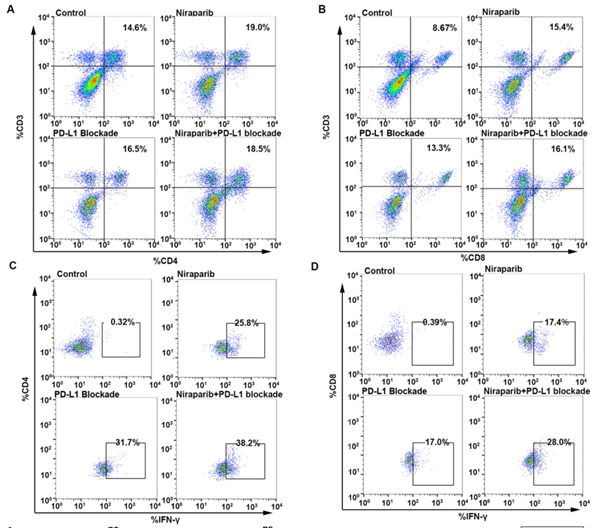
尼拉帕利治疗改变体内免疫细胞的比例和功能
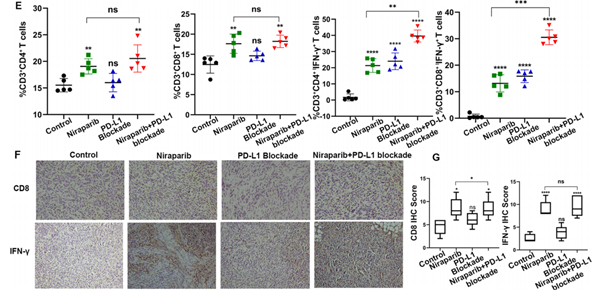
GEPIA(基因表达分析交互式分析)数据库的结果显示,PD-L1与CD8呈正相关(图D);研究中发现1例尼拉帕利治疗患者的CD4+ 和CD8+ T淋巴细胞比例降低,而其他2例患者的CD3+、CD4+和CD8+ T淋巴细胞比例升高,3例患者的T细胞分泌细胞因子升高(图E-K)。
尼拉帕利治疗可增强共培养系统中T淋巴细胞的比例和活性
结果显示,与对照组相比,尼拉帕利给药组的细胞因子分泌显著增加,并且联合给药增强的作用显著超过了尼拉帕利组(图D/F)。
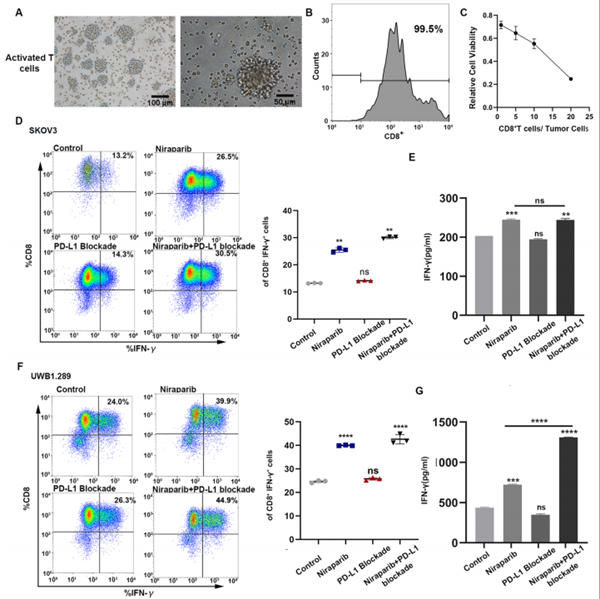
尼拉帕利+PD-L1抑制剂使用可增强体内T淋巴细胞的比例和功能
进一步分析表明,尼拉帕利治疗导致CD8+ T细胞增加,同时IFN-γ生成增加,联合治疗组对比单药治疗组,增强的作用更显著(图F/G)。
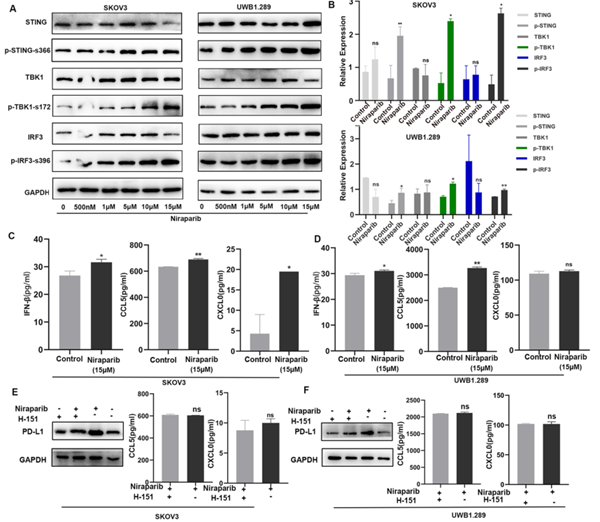
尼拉帕利上调T细胞比例和功能的机制
研究观察到尼拉帕利治疗诱导两个卵巢细胞系中STING 通路的激活。尼拉帕利治疗组IFN-β、CXCL10和CCL5的产生显著增加,解释了PD-L1表达的升高和CD8 + T淋巴细胞的募集(图C/D)。
四、研究结论
研究观察到PARP抑制剂诱导的 DNA 损伤激活STING通路,通过细胞因子CXCL10和CCL5的诱导,上调了PD-L1的表达和CD8+ T淋巴细胞募集。

卵巢癌中PARP抑制剂应答的STING通路活化模型
综上所述,PARP抑制剂尼拉帕利诱导CD8+ T细胞募集,在研究中发挥抗肿瘤作用,PD-L1抑制剂与尼拉帕利具有协同效应,研究证明联合方案具有显著疗效,这为该联合治疗在临床环境中提供强有力的科学依据。此外,还验证cGAS/STING通路在尼拉帕利治疗中的疗效,考虑到T细胞的募集,它可以成为肿瘤治疗的新靶点,临床可以开展进一步研究,探索在卵巢癌中靶向cGAS/STING通路的作用以及PARP抑制剂或ICB的作用。

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
