PARP抑制剂(PARPi)是一种靶向多聚(ADP -核糖)聚合酶的癌症治疗药物,是第一个获得FDA批准上市的利用合成致死效应发挥抗肿瘤作用的药物,目前PARP抑制剂的适应症覆盖了卵巢癌的一线维持、铂敏感复发维持、后线治疗等,同时在乳腺癌、肺癌、胰腺癌、前列腺癌中,PARP抑制剂也具有相应的适应症。虽然临床使用PARPi的契机越来越多,但是你真的完全了解PARPi的作用机制了吗?本期文献精读我们诚邀南昌大学第二附属医院肿瘤科兰琼玉教授,她将为大家分享一篇发表在《Science》杂志上的综述:《PARP inhibitors: Synthetic lethality in the clinic》。


 00:000:00 音频
00:000:00 音频 一、PARP与DNA损伤
PARP作为一种DNA修复酶,是细胞凋亡核心成员半胱天冬酶(caspase)的切割底物,它在DNA损伤修复与细胞凋亡中发挥着重要作用。
细胞在正常代谢过程中因各种内、外因素(内源性活性氧、紫外线等)均可能导致DNA损伤,人体的细胞每天都在经受着数以亿计次的DNA损伤,若细胞累积的DNA损伤得不到正确修复,则可能引起基因突变、癌基因激活、抑癌基因失活及染色体不稳定等,并引发细胞衰老、凋亡、代谢等调控异常,最终可能导致包括肿瘤在内的各种疾病。细胞通过DNA损伤修复(DDR)途径等一系列相互关联的分子途径,来识别 DNA 损伤、延缓细胞周期并介导 DNA 修复,来抵御DNA损伤带来的有害影响,从而保持基因组的完整性。
DDR途径主要包括DNA单链损伤(SSB)和双链损伤(DSB)修复。
1—SSB修复
DNA单链损伤通过错配修复、碱基切除修复和核苷酸切除修复途径进行修复。关键酶是聚腺苷二磷酸(ADP)-核糖聚合酶1 和 2(PARP1 和 PARP2),它们通过在靶蛋白上合成带负电荷的支链聚(ADP-核糖)(PAR)链(PARylation)而发挥作用。PARP 在SSB和其他 DNA损伤处结合受损DNA,导致 PARP结构发生一系列变构变化,从而激活其催化功能。这导致了 DNA 修复效应子(如 XRCC1)的 PARylation 和募集,以及受损 DNA 周围染色质结构的重塑,作为 DNA 修复过程的一部分。PARP最终将自身进行 PARylate 化(autoPARylation)。PAR 链赋予 PARP的负电荷可能导致其从修复的 DNA 中释放。
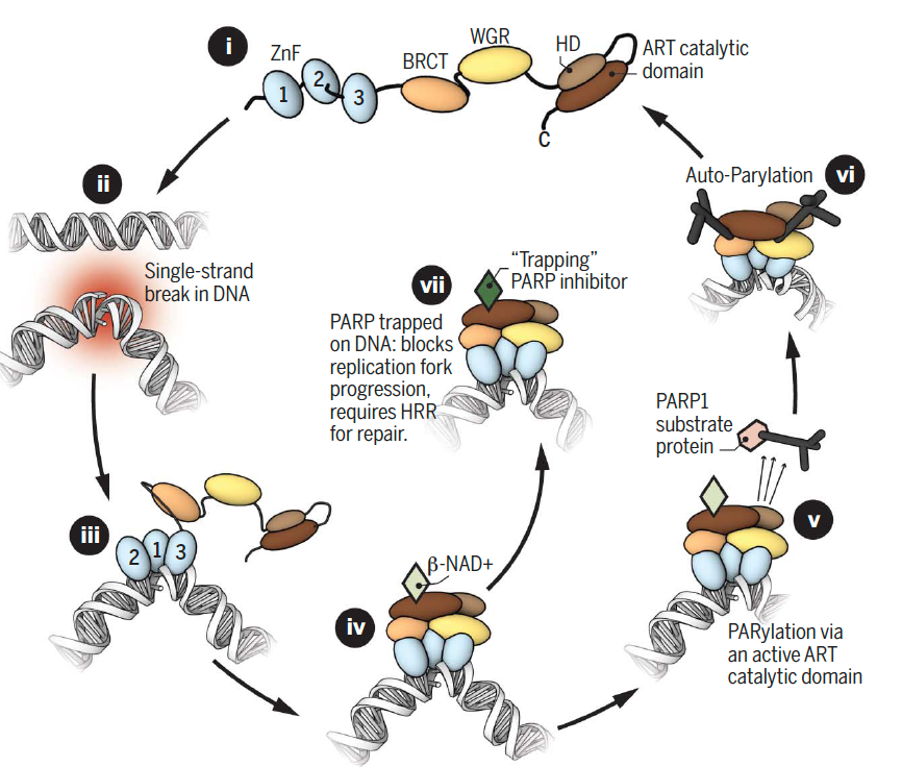
PARP酶修复SSB的机制
● 在非DNA结合状态下,PARP以相对无序的构象存在,通常被称为“串珠”。PARP1的结构域包括三个锌指相关结构域(ZnF1、2和3):BRCA1 C末端结构域(BRCT)、富含色氨酸、甘氨酸和精氨酸的结构域(WGR)和包含两个亚结构域【螺旋结构域(HD)和腺苷转移酶(ART)】的催化结构域。在这种非DNA结合状态下,HD作为自身抑制结构域阻止PARP超家族辅因子b-NAD+与其ART结合位点的结合。
● DNA双螺旋的损伤通常导致SSBs的形成。
● SSBs导致双螺旋的正常方向发生变化,进而为DNA结合PARP ZnF结构域提供结合位点。
● ZnF 1、2和3与DNA的相互作用开始将剩余的PARP蛋白结构域逐步组装到PARP/DNA核蛋白结构上,该过程导致HD构象的改变,并导致自身抑制功能的丧失,从而变构激活PARP催化活性。
● ART催化活性驱动PARP底物蛋白的PAR化,介导DNA修复效应物的募集、染色质重塑和最终DNA修复。
● PARP自行PAR化(可能在SSBs处顺式,但在其他DNA损伤处可能为反式)最终导致PARP从DNA中释放并恢复催化活性状态,进入到下一个循环。
● 结合催化位点,阻止PARP从DNA中释放,在损伤位点“捕获”PARP1,形成PARP-DNA复合物,将PARP从其正常催化循环中移除。
2—DSB修复
DNA双链断裂通过同源重组修复(HRR)或非同源末端连接(NHEJ)进行修复。HRR是指在两个相似或相同的DNA分子核苷酸序列之间交换的一种遗传重组,并且在断端不会出现核苷酸缺失或增加,能精确地修复DNA双链的断裂,确保遗传信息高保真传递。肿瘤细胞往往也是利用HRR使细胞免于凋亡。而作为修复DNA双链损伤的一种重要机制,HRR所涉及到信号通路多且复杂,其中关键蛋白为BRCA1和BRCA2。如果BRCA基因出现突变导致BRCA1和BRCA2蛋白失去功能,就会引起同源重组修复缺陷(Homologous Recombination Deficiency, HRD)。另外,其它HRR相关基因,如 PALB2, CDK12,RAD51, CHEK2, ATM等发生突变、或BRCA1基因启动子发生甲基化、以及其他暂未明确的原因,也都会引起HRD,导致基因组不稳定。而当肿瘤细胞出现HRD,无论是由BRCA1、BRCA2或其他途径成分的缺陷驱动,DNA修复形式则主要是NHEJ。这种修复机制可能会导致DNA改变,包括遗传物质的缺失,并最终导致细胞的凋亡。
二、PARPi的作用机制——合成致死
合成致死:同时改变两个基因或蛋白(PARP和BRCA)会导致细胞死亡,而单独改变任何一个基因或蛋白质不会导致细胞死亡。
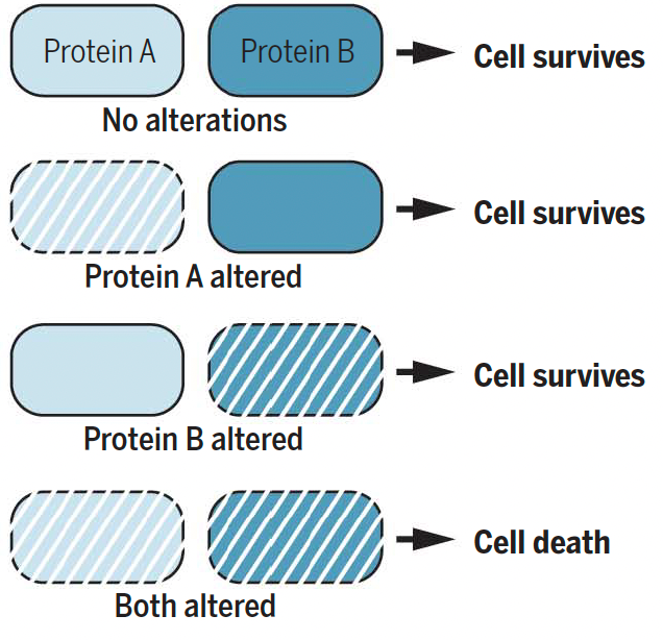
合成致死的简单示意图
当肿瘤细胞出现BRCA突变/HRD,同时PARP被抑制时,就会产生“合成致死”效应,存在BRCA突变/HRD的肿瘤对PARPi更敏感。
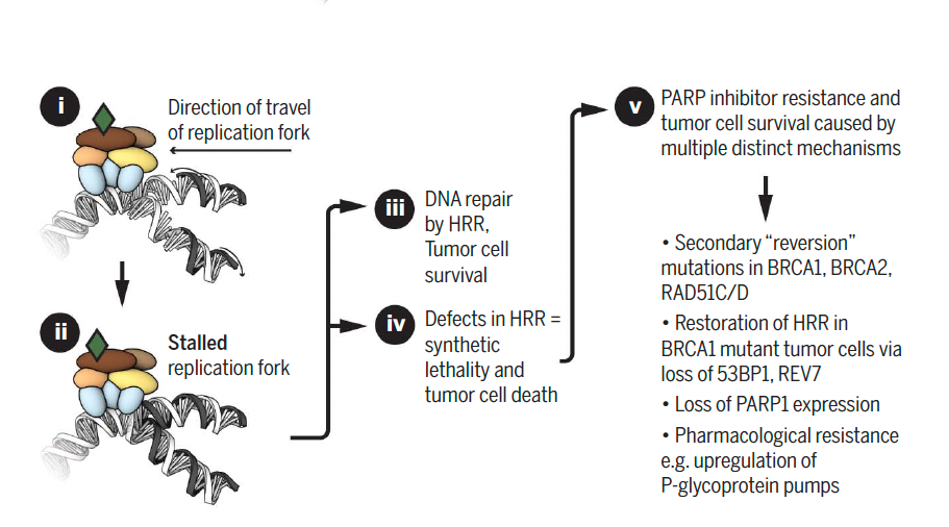
PARPi合成致死模型:PARP捕获形成PARP-DNA复合物损害DNA复制叉
●将PARP捕获在复制叉前面的DNA上。
●复制叉停顿,引起DNA损伤。
● HRR(包括胚系和体系BRCA1和BRCA2抑癌蛋白),是修复和重启被PARPi中断的复制叉进程的最佳DNA修复方法。
● 在HRR存在缺陷的情况下,细胞使用NHEJ等非高保真DNA修复过程,可能产生大规模基因组重排,这往往导致肿瘤细胞死亡和合成致死。
● 多种不同机制导致PARP耐药,肿瘤细胞存活。机制主要包括:(1)BRCA1/2、RAD51C/D回复突变;( 2)BRCA1突变的肿瘤细胞由于53BP1、REV7缺失引起的HRR活性恢复;(3)PARP1表达缺失;( 4)药理耐药:P糖蛋白泵的表达上调。
三、总结
PARPi靶向之路:道阻且长,行则将至;行而不辍,未来可期。
PARPi的成功研发上市,为“合成致死”效应可以转化为癌症治疗的概念提供了强有力的证据,同时也为研发其他可能通过“合成致死”效应达到抗肿瘤效果的基因/蛋白组合提供了宝贵经验。在未来,如果能更好的改善HRp人群的疗效,逐步解决PARPi耐药问题,找到合适的biomarker优化PARPi联合治疗的模式,并基于PARP家族成员间结构的差异来设计合成具有高度亚型选择性的PARPi,我们相信小分子PARPi一定能给肿瘤患者带来更为可观的获益。

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
