大量回顾性研究表明,在上皮性卵巢癌(OC)中,瘤内免疫细胞浸润密度与预后有关,为在卵巢癌中探索PD-1和PD-L1抑制剂的疗效提供了理论依据。而迄今为止评估复发卵巢癌患者PD1/PD-L1抑制剂的临床试验多令人失望。今天邀请到浙江大学医学院附属第二医院妇科周建维教授,为大家分享一篇发表在《医学肿瘤学治疗进展》的综述,《Immune checkpoint inhibitors in ovarian cancer: where do we stand?》。在这篇综述中,作者讨论了单药PD1/PD-L1抑制剂的早期研究结果,以及增强卵巢癌中免疫治疗获益的策略。


 00:000:00 音频
00:000:00 音频
一、卵巢癌中PD-1/PD-L1抑制剂的早期临床研究数据
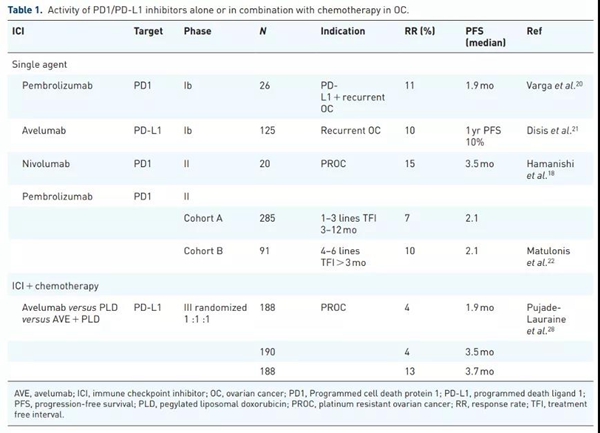
二、提高免疫检查点抑制剂在卵巢癌中的疗效-联合方案
在大多数患者中,癌症免疫周期并没有达到最佳状态,在周期的各个阶段增强免疫反应,是目前的开发策略之一。可能的方法包括使用细胞毒药物或靶向治疗增加TAA释放,使用血管内皮生长因子抑制剂促进T细胞浸润到肿瘤,或使用CTLA4抗体增加T细胞启动和激活。
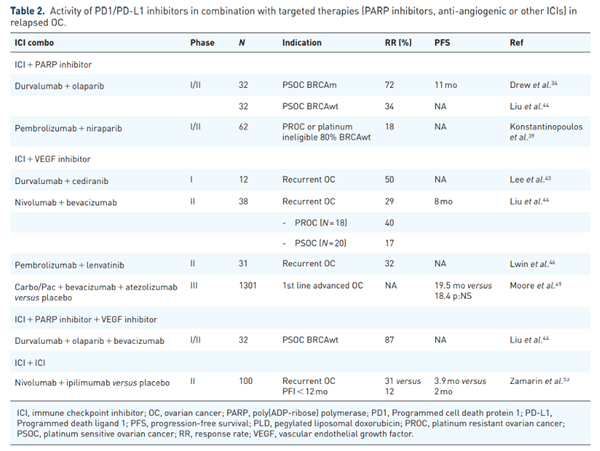
PD1/PD-L1抑制剂联合PARP抑制剂
大约25%的高级别卵巢癌(HGOCs)与BRCA1或BRCA2突变相关,这些肿瘤经常表现出更强的CD8+淋巴细胞浸润,更高水平的新生抗原,更高的PD-L1表达。
临床前数据表明,PARPi诱导的细胞肿瘤死亡可能部分通过免疫原性机制介导。PARPi会导致胞质双链DNA的积累,从而导致胞质DNA传感器环状GMP-AMP合成酶(cGAS)和干扰素基因刺激器(STING)通路的激活。这种免疫原性信号反过来上调干扰素基因的表达,增加DC抗原提呈能力以及CD8+介导的抗肿瘤免疫应答。因此,PARPi可以从PD-L1/PD1抑制剂中获益,即使在BRCA野生型卵巢癌中也已得到验证。
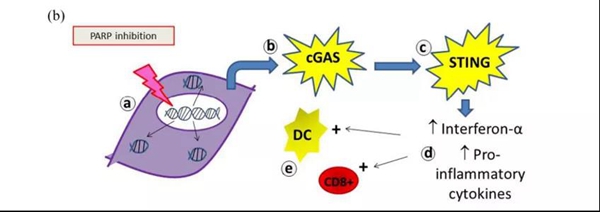
TOPACIO试验评估了PARP抑制剂尼拉帕利联合帕博利珠单抗治疗复发性卵巢癌患者,无论BRCA突变状态或铂敏感性如何,客观缓解率为18%。在某些BRCA野生型铂耐药患者中观察到长时间应答,而在其他单药治疗下是无应答的,还需要进一步的研究来确定这种联合是否真的具有增效作用。正在进行的III期试验ANITA研究将评估含铂化疗伴或不伴阿特珠单抗后,尼拉帕利维持,伴或不伴阿特珠单抗,对铂敏感复发性OC患者的疗效。
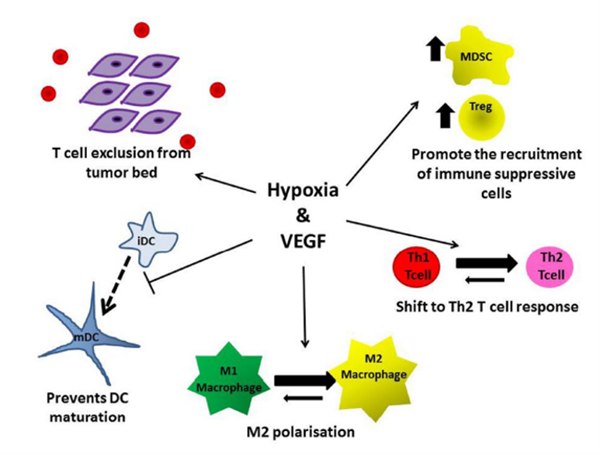
PD1/PD-L1抑制剂联合抗血管生成药物
在肿瘤微环境缺氧条件下,抑瘤TH1免疫反应普遍转变为促瘤TH2免疫反应,Treg的募集导致肿瘤耐受和新血管生成。此外, DC成熟被抑制,导致抗原呈递受损和肿瘤特异性CD8+ T细胞的激活。这还伴随着组织相关巨噬细胞的浸润,通过上调生长因子促进肿瘤进展。因此,VEGF抑制剂可以与免疫检查点抑制剂产生协同作用,使肿瘤血管正常化,从而增加免疫效应细胞对肿瘤的浸润,促进免疫抑制向促炎抗肿瘤的转变。
PD1/PD-L1抑制剂联合CTLA4抑制剂
卵巢癌临床前研究表明,多达一半的肿瘤浸润淋巴细胞中CTLA4和PD-1都是阳性的,而且对这两种免疫检查点的双重封锁,应答比单独使用任何一种药物都增加一倍。
三、克服卵巢癌中的免疫检查点抑制剂耐药
靶向磷脂酰肌醇3-激酶(PI3K)/Akt或Wnt通路
PI3K-Akt通路的激活和/或磷酸酶和紧张素同源物(PTEN)蛋白的丢失已经被证明可以抑制T细胞浸润和细胞毒性,在OC中经常观察到PI3K/PTEN通路的改变。
肿瘤浸润调节性 T 细胞(Treg)介导了一种促肿瘤形成的抗炎肿瘤微环境,与OC中预后较差相关,而Treg的缺失增强了抗肿瘤免疫并促进肿瘤消退。与传统T细胞相比,PI3K和Akt抑制剂选择性地抑制人和小鼠Treg细胞的增殖,导致Treg依赖的抗肿瘤治疗效果增强,目前正在进行多项探索这种联合的临床研究。
最近发现未经治疗的高级别浆液性卵巢癌的免疫细胞排斥与Wnt通路负调控因子的功能突变有关,导致Wnt信号通路增加和MYC靶基因的扩增。Wnt介导的免疫排斥在黑色素瘤中也有报道。目前正在探索几种下调肿瘤中Wnt通路的治疗方法,包括通过抑制酰基转移酶(PORCN)。
四、预测生物标志物识别优势人群TMB?
PD-L1 ?dMMR?OCCC?SCCOHT?
BRCA1/2突变的卵巢癌或其他缺陷导致HRD的肿瘤与更高水平的TILs和PD-L1表达有关,这是否也使ICIs更敏感还需要进一步研究。TOPACIO研究中主要包括BRCA野生型铂耐药患者,证明了同源重组缺陷信号以及肿瘤微环境中干扰素介导的枯竭T细胞的存在预测作用。
五、结论
尽管有强大的生物学原理,但上皮性OC尚未被证明是免疫检查点抑制剂的理想候选者。典型的“免疫冷肿瘤”卵巢癌可能需要联合方案来提高免疫治疗的效益。进一步了解卵巢癌肿瘤微环境的独特分子和免疫特征将有助于优化免疫检查点抑制剂在卵巢癌患者中的疗效。

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
