在过去十年中,聚腺苷二磷酸核糖聚合酶抑制剂(PARPi)彻底改变了OC (Ovarian Cancer,卵巢癌) 治疗的格局。PARPi作为铂类化疗后维持治疗的III期试验 [NOVA、SOLO2 和 ARIEL3] 无进展生存期PFS显著延长,但ICIs(Immune Checkpoint Inhibitors,免疫检查点抑制剂)单药疗法在卵巢癌治疗方面效果不佳,目前使用抗PDL1 或抗CTLA4等单一药物的中位缓解率仅为10-15% 。
然而有研究显示,HRD(Homologous Recombination Deficiency,同源重组修复缺陷)阳性肿瘤中T细胞炎症有所增强,而且PARP抑制剂和抗CTLA4或抗PD(L)1抑制剂也在临床前研究中被证实在携带BRCA突变的上皮性卵巢癌中具有协同抗肿瘤作用。
但是PARPi和免疫检查点抑制剂究竟是如何发挥协同作用的呢?本期OC资讯我们特邀湖南省肿瘤医院妇瘤3科欧阳强教授分享一篇最新的综述《The Role of PARP Inhibitors in the Ovarian Cancer Microenvironment: Moving Forward From Synthetic Lethality》,为大家揭开PARPi和ICIs“共同富裕”的秘密。


 00:000:00 音频
00:000:00 音频 1、BRCA:与 BRCA2 相比, BRCA1突变在基因组水平上具有不同的免疫调节作用
卵巢癌中,BRCA1或BRCA2有害突变分别占36-60%和16-27%。约10%的高级别浆液性卵巢癌患者通过启动子甲基化导致BRCA1功能的丧失。最近有数据表明,BRCA1和BRCA2以不同的方式影响肿瘤发生、微环境和免疫反应,这将导致截然不同的突变格局 。BRCA2突变在同源重组(HR)中具有已知的核心功能,同源重组修复(HR)和错配修复(MMR)都是肿瘤细胞最常见的DNA损伤修复途径之一,它们的功能异常将导致更高的肿瘤突变负荷,并且dMMR(Deficient Mismatch Repair,错配修复缺陷)已经被FDA批准作为对ICIs治疗疗效的预测标记。
与BRCA2wt细胞系相比,当暴露于ICIs,特别是抗PD1 或双免(抗CTLA 4 和抗 PD1)时,BRCA2mut哺乳动物肿瘤的生长明显延迟。而BRCA1mut 小鼠模型情况并非如此 。对 ICIs 诱发反应的差异是适应性和先天免疫激活不同效应的结果,比如,BRCA1突变表现出免疫抑制和调节基因的上调,而 BRCA2 突变则表现出免疫细胞激活基因的上调。
但这些结果都只是临床前的相关研究,并且没有在EOC模型中验证,还需要做进一步的生物标记物筛选。即便如此,我们仍然有理由认为OC免疫治疗的失败可能是由于我们对影响微环境和免疫反应的其他因素的了解不够完全所致。
2、PARP在免疫系统中的作用
在小鼠模型中T细胞发育的所有阶段都需要PARP,PARP2的缺乏可以降低胸腺细胞的数量,导致其成熟过程中更多的细胞凋亡。而且,PARP1和2的缺乏导致外周血CD4+和CD8+细胞减少,不仅如此,PARP还参与了细胞激活,PARP1缺乏可以将T细胞导向到Th1和Treg表型而非Th2。B淋巴细胞也会受到类似的影响(但原因尚不完全清楚),这些与PARP在细胞增殖过程中需要防止DNA损伤积累的假设是一致 。
PARP在中性粒细胞的激活和募集 、 巨噬细胞表达促炎细胞因子如IL6 、TNF以及树突状细胞的募集(其中PARP1参与,但PARP2的作用尚不清楚)。总之,PARP抑制的作用是十分复杂的 。
3、PARPi协同ICIs实现“共同富裕”的秘密
(1)缺氧
实体肿瘤氧合表达水平不尽相同,特别是当以高细胞复制为特征时。可以确定哪些区域的血管生成无法为快速增长的肿瘤提供足够的氧气,这将不同程度缺氧的特征对预后有负面影响,因为它是肿瘤快速增殖的标志,而且它与放化疗耐药、DNA修复能力下降、转移扩散风险增加有关。严重和慢性缺氧都会通过减少RAD51、BRCA1和BRCA2等蛋白的翻译而导致HR通路中断,这对DNA双链断裂修复至关重要;即使在慢性中度缺氧水平下,RAD51仍然受到抑制。值得注意的是,这是观察到的第一个独立于缺氧诱导因子1α (HIF1alfa)的机制。随后该机制还解释了,在不论BRCA突变状态下,HR缺陷的缺氧细胞是如何实现对PARPi敏感的。其提到的环境合成致死效应,即缺氧等外部条件可以改变肿瘤细胞的机制,使其对靶向治疗敏感,肯定值得进一步探索,并可以为临床使用PARPi提供新的契机,目前尼拉帕利联合贝伐单抗对比尼拉帕利单药治疗铂敏感复发性卵巢癌的AVANOVA2研究已经达到了主要研究终点,mPFS:11.9月(尼拉联合贝伐) vs 5.5月(尼拉),HR:0.35(0.21-0.57) p<0.0001。
(2)STING 通路
越来越多的证据表明DNA损伤与免疫系统之间的相互作用在癌症治疗的成功中起着重要作用。受到影响的众多途径之一是cGAS-cGAMP-STING;致病性DNA的存在会引起STING(干扰素基因刺激因子)的上调,从而产生更多的干扰素?和促炎细胞因子。Ding等人进一步深入研究了这个概念,观察到奥拉帕利增加了肿瘤内CD4+和CD8+细胞表达,减少了抑制性受体的产生,增加了肿瘤相关树突细胞的募集和活性,因此提供了先天和适应性的强大免疫激活。Shapiro等人将BRCA1缺陷型三阴性乳腺肿瘤细胞移植到小鼠模型中,通过激活STING通路,Olaparib显着增加了CD3+和CD8+T细胞表达。CD8+细胞和NK中颗粒酶B的表达也增加,表明其具有溶解细胞的作用。当CD4+T细胞增加时,Treg表型并未增多,说明有更高的辅助性T细胞分化。并且发现INFb、CCL5和CXCL10(与T细胞浸润相关的有效促炎信号)的mRNA水平过度表达。但在BRCA1基因正常的情况中,情况并非如此。
这些发现表明,PARPi是一种有效的细胞毒性细胞募集和激活的诱导剂,但在HRD缺陷或BRCA突变模型中,其作用更为突出。
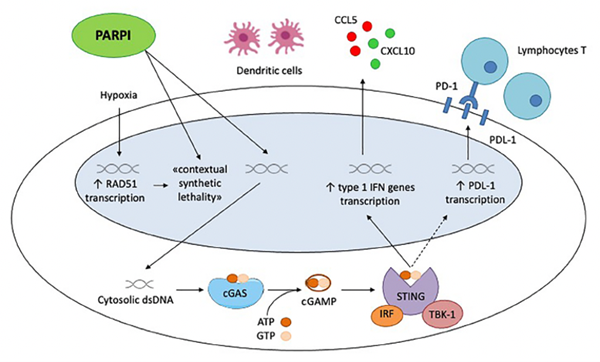
PARP抑制剂对肿瘤细胞和微环境的影响
(3)PD-L1上调
免疫检查点在癌症发生过程中起到了十分重要的作用,许多肿瘤细胞同时表达PD-L1和2,它们的过表达导致适应性免疫系统的多个信号通路受损。Dyng等人的研究发现接受奥拉帕利治疗后,小鼠的PD-L1表达上调,奥拉帕利联合PD-L1效果显著,而单独抗PD-L1疗效甚微或无反应。Shen等人通过一个不同于Dyng的模型发现,在HR正常的情况下,Talazoparib与抗PDL1协同使用,再次观察到PD-L1的表达上调和肿瘤对PARPi联合ICIs治疗的显著应答。
除了通过免疫信号间接刺激外,PARPi还可能通过GSK3β的失活来诱导PD-L1水平的上调。有研究证实奥拉帕利治疗GSK3β敲除小鼠模型时PD-L1没有升高。当PARPi与ICIs联合治疗时,PD-L1和PD1水平升高引起的T细胞杀伤障碍似乎可以得到逆转。
虽然肿瘤细胞的PD-L1表达可以预测某些癌症类型(即非小细胞肺癌和尿路上皮癌)对ICIs的疗效,但它在EOC中的表达并不多见(10-33%),甚至其在EOC中的疗效预测作用还存在争议。有数据表明PD-L1的高表达意味着更差的预后,但也有数据表明,更高的PD-L1表达与更长的PFS相关。
不过,在TOPACIO试验中,探索性的亚组分析未发现尼拉帕利联合帕博利珠单抗在PD-1高表达和低表达状态下的临床疗效存在差异,因此,PD-1表达水平并不是一种预后预测指标。
4、总结
PARPi无疑已经彻底改变了OC的前景,但是仍然存在使用PARPi后进展的问题,还需要探索新的治疗方法。PARPi可以通过抑制DNA修复和随后的双链断裂积累增加了新抗原负荷并通过STING通路刺激免疫系统。OC一直被认为对ICIs反应不佳,但现在的数据为这一问题提供了新的线索。同时使用PARPi和其他靶向治疗来影响免疫系统和肿瘤微环境可能是更成功的方法。到目前为止,临床前研究已经为ICIs和PARPi之间的关系提供了强有力的证据;在BRCA1突变的卵巢癌模型中,结合抗CTLA4和PARPi可促进长期应答,这是由于肿瘤环境中IFNγ的局部增加以及随后T细胞的募集和激活和细胞因子的产生。
遗憾的是,PARPi联合ICIs的疗效截止目前并不一致,这表明在未来需要根据肿瘤的遗传和微环境特征来进一步确定biomarker。

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
