目前卵巢癌的全球防控形势依然十分严峻,晚期卵巢癌患者即便初始治疗有效,也无法避免再次复发的结局。
对于III期达到满意减瘤的卵巢癌患者,相比于静脉化疗,初始肿瘤细胞减灭术后使用顺铂和紫杉醇进行腹腔化疗可提高无进展生存期(progress free survival, PFS)和总生存期(overall survival, OS)。尽管有生存获益,但由于毒性和实施过程较为困难,腹腔化疗的治疗手段仍然没有很好的普及。
但腹腔热灌注化疗 (hyperthermic intraperitoneal chemotherapy, HIPEC)与术后腹腔化疗不同,因为它是在完成肿瘤细胞减灭术后以高热状态进行腹膜内单次给药。热疗具有直接的细胞毒性作用并可以增强铂类的肿瘤渗透和促进DNA加合物形成。
顺铂(100 mg/m2)HIPEC已被证明在新辅助化疗后接受间歇性减瘤术的III期卵巢癌患者中可取得显著的PFS和OS获益,并且安全性可控。
铂敏感复发性卵巢癌患者二次减瘤术期间使用卡铂腹腔热灌注化疗,能获益吗?
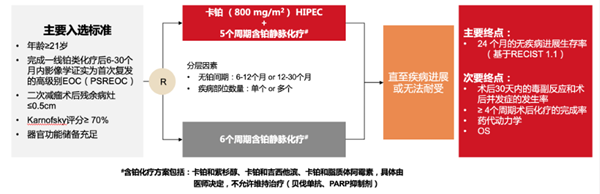
本次我们邀请到了湖南省肿瘤医院的唐洁教授,为我们解读发表在ASCO官方杂志《Journal of Clinical Oncology》上的一项随机、多中心、开放标签II期研究。研究目的是评估复发性卵巢癌患者二次减瘤术期间使用卡铂(800 mg/m2) HIPEC的疗效 (NCT:01767675)。

 00:000:00 音频
00:000:00 音频 01.试验设计
02.统计学设计
基于二项式单阶段挑选优胜者(binomial single-stage pick-the-winner design)的设计,假如术后24个月某个组49例患者中有超过17名病例无疾病进展,则认为该组为优胜者。
03.结果
患者流情况
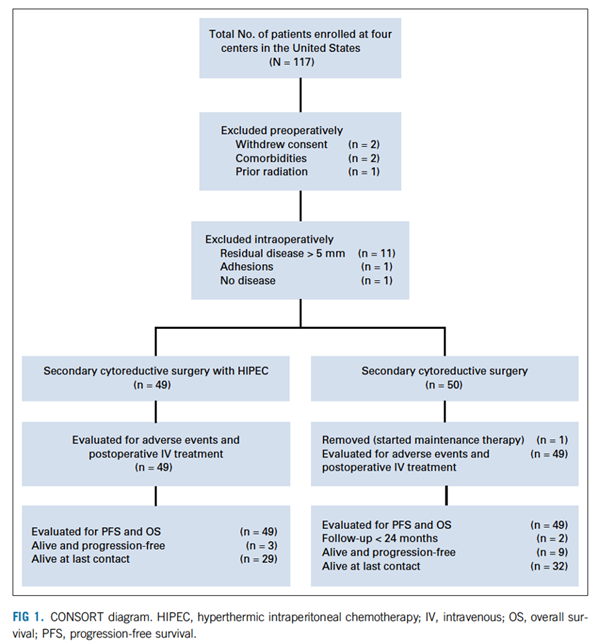
从2014年2月至2019年11月,共有117名患者签署知情同意(FIG 1) 。99名患者被随机分配接受二次减瘤术后进行6个周期卡铂静脉注射化疗或卡铂 (800 mg/m2) HIPEC后进行5个周期卡铂静脉注射化疗。
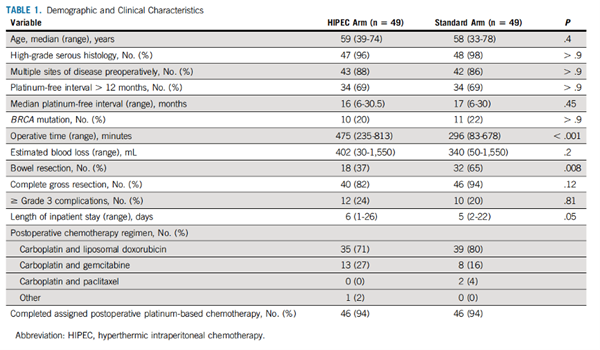
患者基线特征(TABLE1)
除了手术时间和是否行肠切除术,其他基线平衡可比。
主要终点:二次减瘤术后24个月时无疾病进展生存率
24个月时,HIPEC组中有8例患者(16.3%;单侧90%CI:9.7-100)没有发生疾病进展或死亡,标准组中为12例(24.5%;单侧90% CI:16.5-100)。整个队列的中位PFS和OS分别为14.3个月(95%CI, 12-16)和55.2个月(95%CI, 50.3-78)。肿瘤完全切除(complete gross resection, CGR)患者的中位PFS和OS分别为15.1个月和59.7个月。生存曲线见FIG 3A和FIG 3B。
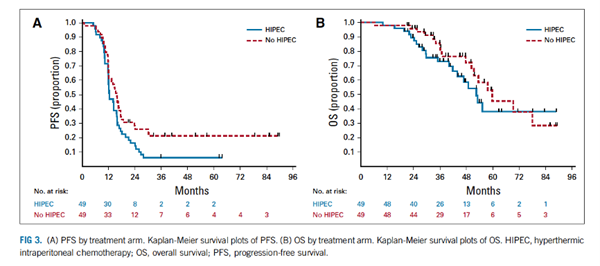
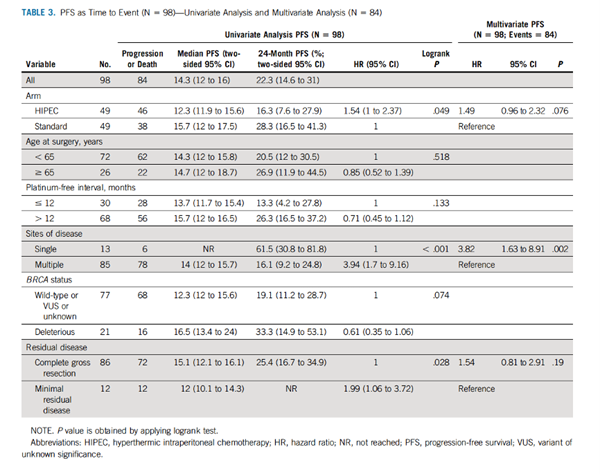
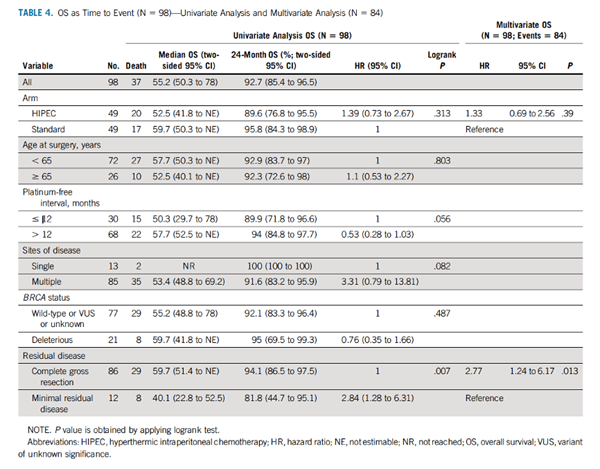
HIPEC组患者中位PFS为12.3个月,OS为52.5个月,而标准组PFS为15.7个月,OS为59.7个月。PFS和OS的单因素分析和多因素分析见TABLE 3和TABLE 4。
从TABLE 3中可以看出,单发病灶的患者PFS获益更为显著(P<0.001)。
而TABLE 4的结果提示:CGR亚组的OS具有显著获益(P=0.007)。
在对所有复发病例的术后盲法检查中,两组在复发部位上(腹膜、淋巴结、胸膜)没有差异(TABLE A2)。
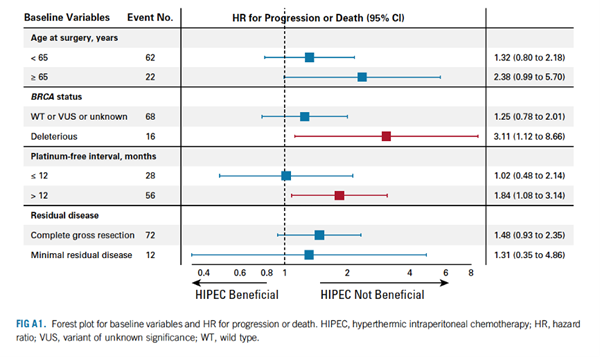
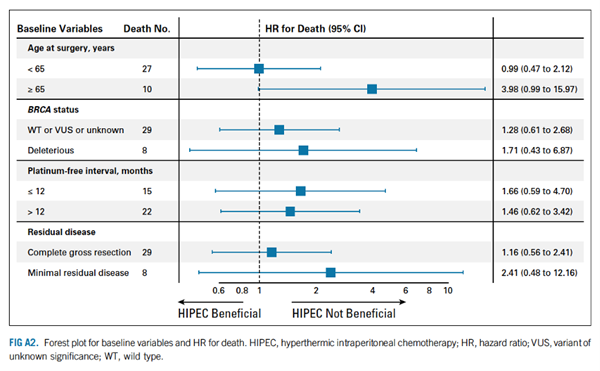
为了评估HIPEC对其他患者变量的影响,研究者创建了PFS和OS的非计划Cox PH模型(FIG A1和A2)。在这项分析中,既往无铂间期较长的患者和已知有害BRCA突变的患者在HIPEC中似乎没有PFS获益。
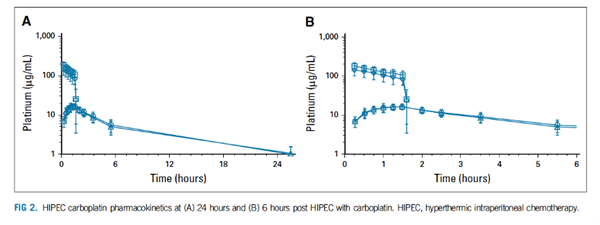
卡铂的药代动力学
卡铂作为HIPEC给药后的药代动力学如FIG 2所示。血浆中铂类含量在灌注过程中逐渐升高,接近灌注结束时趋于稳定。
腹膜和血浆中最大超滤铂浓度的几何平均值(几何标准差)分别为140 (1.28)ug/mL和16.7 (1.24)ug/mL,腹膜-血浆比值为8.47 (TABLE A1)。
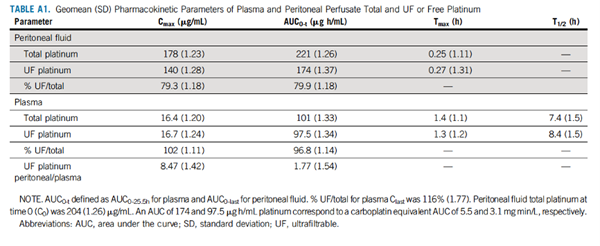
腹膜和血浆对应的铂AUC值分别为174 (1.37)ug·h/mL和97.5 (1.34)ug·h/mL,腹膜-血浆比值为1.77。3例患者可获得治疗后肿瘤组织(1cm3),铂组织浓度的几何平均值(几何标准差)为3.38 (1.62)ug/g。
安全性
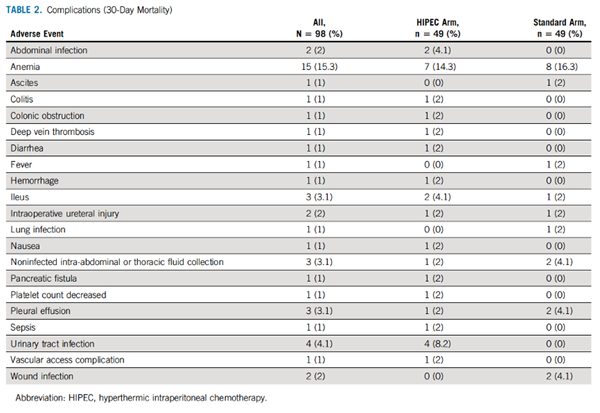
没有观察到30天的死亡率。术后30天内并发症的发病率无差异(TABLE 2), 92例(94%)患者完成了所有指定的术后静脉化疗,组间无差异。术后最常见的化疗方案为卡铂和脂质体阿霉素,有74例(76%)。从手术到开始术后静脉化疗的中位时间为32天(18-91天),两组间无差异。
04.总结
这项研究有利有弊,设计之初,研究者担心顺铂可能引起肾毒性,所以选择了卡铂,并且在患者治疗方面尽量做到了平衡。但是,研究仍然存在着一些偏倚。
第一,该研究并没有对术后残留病灶进行具体分层,只是笼统地将二次减瘤术后残余病灶达到< 0.5 cm设为入组标准,而且两组均有相当多比例的患者达到了完全肿瘤切除,这有可能给实验带来一定程度的偏倚。
第二,因为是开放的II期研究,随机分配到HIPEC组患者本来可以通过肠切除术实现完全肿瘤切除,但是外科医生可能会出于肠切除术本身会增加术后并发症的发生率而选择不做到肿瘤完全切除,残留部分微小病灶。因为术后并发症也是次要观察终点之一。而且,根据既往的随机实验结果,HIPEC组的造口率应该更高一些,本研究并未发现这一现象,这些可能都是术中偏倚所致。
第三,术中随机分配明显延长了手术时间,因为牵涉到药物准备、运送到手术室以及HIPEC的设置等,导致手术时间明显延长了3小时。对病人的安全提出了挑战。
当然由于这个研究启动之初还没有药物获得FDA批准用于PSROC患者维持治疗,但是研究过程中,贝伐和PARP抑制剂都相继获批,为了避免两组之间潜在的治疗不平衡,在征得患者同意后并没有使用任何维持治疗。而且研究设计时,无铂间期大于30个月的患者不符合入组条件,故中位无铂间期为16个月,这大大短于近期评估二次减瘤术对铂敏感卵巢癌患者作用的研究报告的结果。而且,肠切除术作为肿瘤细胞减灭术的一部分,本研究中51%的患者需要进行肠切除术。这明显高于GOG213中报告的28%,表明参加该试验的患者具有更高的疾病负担。从维持治疗的省略、更短的无铂间期和高风险患者的纳入方面来看,这或许可以为该研究中相对比较短的中位 PFS做出一些解释。
综上所述,虽然二次减瘤术后使用卡铂HIPEC耐受性良好,但是由于无一治疗组在24个月时达到预设的17例无疾病进展患者的终点,故并不能确定孰优孰劣。而且与历史对照的标准治疗(25.5%)相比,并未产生更好的结果,24个月时无疾病进展生存率HIPEC组为16.3%(8例),标准组为24.5%(12例) 。所以该项研究不支持铂敏感复发性卵巢癌患者在二次减瘤术期间使用卡铂(800 mg/m2)HIPEC。在未来,需要进一步的研究来解决如何优化 HIPEC 与术中随机分配过程的关系,以最大限度地减少外科医生的偏倚,同时,也应仔细考虑相关的分层因素,如残留疾病和BRCA状态等。

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助

