目前人们对提高 PAPR 抑制剂的疗效和克服适应性耐药而选择合适的治疗方案越来越感兴趣,PAPR抑制剂显著提高了卵巢癌治疗和维持治疗的疗效;随着临床上应用 PAPR 抑制剂的增多,更好地理解 PARP抑制剂耐药机制至关重要。今天邀请到了山东省立医院-李长忠医生解读 2021 年近期发表在《Curr OpinObstet Gynecol》的一篇综述《PARP 抑制剂耐药的现状和治疗未来前景》,作者来自于美国德克萨斯大学安德森癌症中心的 Shannon N. Westin 教授。这篇综述主要介绍了克服 PARP 抑制剂耐药的相关策略和目前的关键临床试验。


 00:000:00 音频
00:000:00 音频 01背景
在过去的十年中,PARP 抑制剂发展迅速, FDA 批准了 PAPR 抑制剂用于卵巢癌的治疗和维持治疗的适应症。大多数卵巢癌患者可能会在病程中的某个时间接受 PAPR 抑制剂治疗。然而,对 PAPR 抑制剂最初有应答的大多数患者可能逐渐发展为 PAPR 抑制剂耐药;而那些在病程的后期接受 PAPR 抑制剂治疗的患者,随着既往治疗线的增加,客观缓解率逐步下降。因此,除了 HRD 之外,探索联合治疗方案来克服对PAPR 抑制剂耐药和增加 PARP 抑制剂敏感性是临床中未满足的需求。
02PARP 抑制耐药机制及其临床意义
PAPR 抑制剂耐药可以发生在 PAPR 抑制剂的维持治疗或治疗阶段。
PAPR 抑制剂的原发性耐药和获得性耐药的多种机制包括 53BP1 失活、PARP1 表达缺失、BRCA 亚效等位基因突变和获得性回复突变;其中回复突变已经在临床前和临床研究中得到证实(表1)。因此,重新诱导 HRD 的方法为发生回复突变的患者和基线时同源重组正常(HRP)的患者提供了选择。

03增加同源重组功能缺陷的新机会
抗血管生成药物
大量的临床前数据显示了缺氧细胞中 DNA 修复和基因组不稳定性之间的关系,而临床研究显示贝伐单抗与 PAPR 抑制剂联合治疗同源重组正常(HRP)肿瘤的结果不尽一致。
奥拉帕利联合贝伐单抗 vs 贝伐单抗一线维持治疗卵巢癌 PAOLA-1 研究亚组分析显示:HRD 状态与无进展生存期(PFS)相关。(HRD 队列:HR:0.33;HRP 队列无显著性差异,HR:0.92);
另外,尼拉帕利联合贝伐单抗对比尼拉帕利单药治疗的 AVANOVA2 研究亚组分析显示,无论 HRD状态如何,HRP 患者均显著获益。
近期来自于 2021 SGO 报道了 OVARIO 研究的更新数据,结果显示尼拉帕利联合贝伐单抗治疗18个月的 PFS 率显著得到改善 (HRD 队列:76%,HRP 队列:47%)。
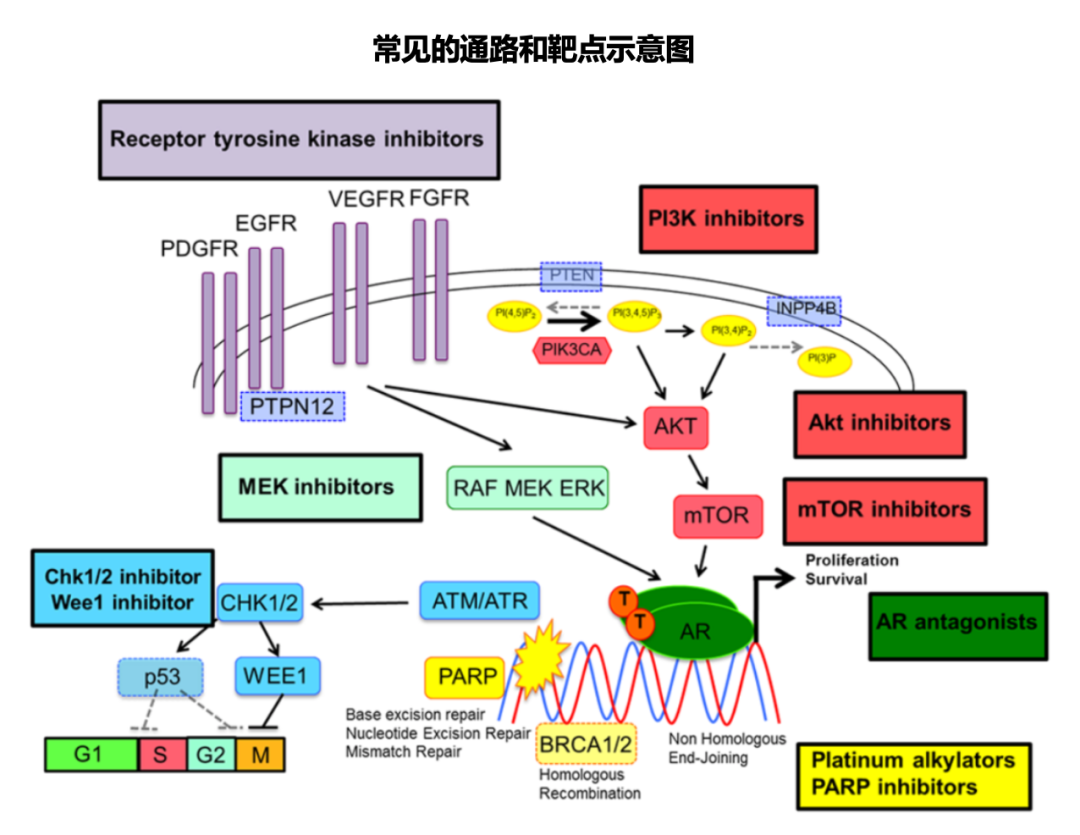
PI3K/AKT/mTOR 通路抑制剂
PTEN 是肿瘤抑制基因,是编码调控 PI3K/AKT 通路的关键磷酸酶,其缺失可能导致同源重组功能减弱。基于与PAPR抑制剂联合的协同作用,那么 PI3K/AKT/mTORi 下调同源重组功能开启了治疗 BRCA野生型卵巢癌新机会。
来自于 2021 ASCO 报道了 mTOR 抑制剂(vistusertib)联合阿那曲唑治疗激素受体阳性/晚期或复发性子宫内膜癌患者疗效的研究初现疗效(ORR:24.5%)。
RAS/MAPK 通路抑制剂
MEK1/2 抑制剂是针对 MAPK 通路的高选择性抗肿瘤药物。MEK 抑制剂增加了 PARP 表达水平,降低了同源重组修复能力。这种潜在 MEK 抑制剂联合 PAPR 抑制剂的协同作用在临床试验中也得到验证(NCT03162627);初步结果显示了良好的抗肿瘤活性,其中所有获益的患者都是 BRCA 野生型。
其他相关靶点
在实体肿瘤中诱导 HRD 的新靶点是溴-结构域(BRD)和组蛋白去乙酰化酶(HDAC)抑制剂(参与转录调控或染色质重构)和热休克蛋白 90 (HSP90)抑制剂(蛋白质稳态的关键调控因子)。临床前数据显示这三种新靶点下调了卵巢癌细胞和异种移植模型的同源重组修复功能,增强了 PAPR 抑制剂的活性。但这三类抑制剂目前都还没有实现较好的临床转化。
04利用 DNA 损伤通路
DNA 损伤和 PARP 抑制剂之间的协同作用是治疗 HRD 肿瘤的治疗策略之一。即使是在同源重组修复功能正常或者功能缺陷后回复的肿瘤中,靶向 DNA 修复通路的下游通路也是克服 PAPR 抑制剂耐药或改善 PAPR 抑制剂疗效的一种策略。
Wee1
Wee1 是细胞周期 G2/M 期检查点的调控分子,当被激活时,会导致 G2/M 细胞周期阻滞和 Cdk1 的磷酸化,从而阻碍了同源重组修复。临床前证据表明这种联合治疗具有协同作用。
最新来自于 2021 年 ASCO 报道了一项评价 WEE1抑制剂(adavosertib)单药联合或不联合 PARP抑制剂治疗 PARP 抑制剂耐药的卵巢癌的 II 期研究,结果显示联合组或单药组均对 PARP 抑制剂耐药的卵巢癌有效(ORR 29% vs 23%)。
Chk1
Chk1 作为 Wee1 的激活蛋白,它是与 PAPR 抑制剂联合治疗的另一个靶点。Chk1 抑制剂联合 PAPR抑制剂治疗既往接受过PAPR抑制剂的BRCA突变的卵巢癌 I期临床试验也正在进行中 (NCT03057145),也非常期待后续能有不错结果。
ATR
ATR 是 Chk1 的上游通路,ATR 存在于 PAPR 抑制剂耐药的 BRCA 突变细胞中。
临床上,ATR 抑制剂联合 PARP 抑制剂也对 PARP 抑制剂耐药的卵巢癌进行了初步探索;
来自于 2021 ASCO 报道了一项 PARP 抑制剂+ATR 抑制剂(Ceralasertib)治疗 PARP 抑制剂获得性耐药复发卵巢癌的一项研究,结果显示出临床获益(ORR:46%)。
EZH2
EZH2 抑制剂可以诱导同源重组感受态细胞优先选择非同源末端连接。EZH2 抑制剂与 carm1 调控的SWI/SNF 复合物联合具有合成致死作用。CARM1 过表达通常与 BRCA 突变相互独立的,因此,在 carm1高表达的肿瘤亚组中,这种联合治疗可能会有潜力。
来自于 2021 ASCO 报道了一项关于 EZH2 抑制剂在包括卵巢癌在内的晚期实体瘤中的1/2研究,结果显示出较好的疗效和耐受性(NCT04104776)。
05利用肿瘤免疫微环境
PAPR 抑制剂和免疫治疗之间通过两种不同的机制产生协同作用。
首先,HRD 导致双链断裂,容易错误修复,导致体细胞突变,可能增加新生抗原形成。
第二,容易出错的 DNA 修复导致细胞质的 DNA 片段通过 DNA 感应的 STING 通路被免疫系统识别并激活。
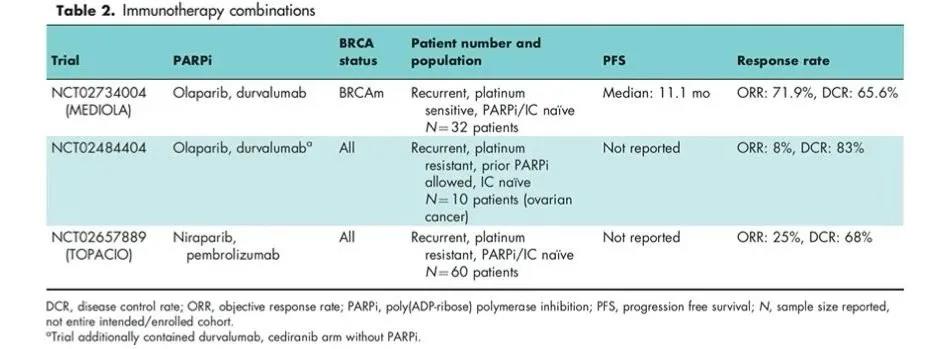
因此,目前许多不同的临床研究正在验证免疫检查点抑制剂联合 PAPR 抑制剂疗效 (表 2)。
06未来和总结
选择潜在的联合药物,是克服 PAPR 抑制剂耐药的关键。针对特定患者人群最有效的联合药物方案,临床上仍没有确定的答案。预测和评估基因组或表观遗传变化的适应性应答,或许可以帮助合理地选择联合治疗方案和避免获得性耐药。改善卵巢癌的的预后,优化基于特定肿瘤分子机制的联合治疗,实现药物的协同作用是靶向治疗的最终临床目标。
参考文献:Emily Hinchcliff, Anca Chelariu-Raicu, and Shannon N. Westin .Current and future landscape of poly (ADP-ribose) polymerase inhibition resistance .Curr Opin Obstet Gynecol 2021, 33:19–25.

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
