一直以来,晚期卵巢癌和子宫内膜癌预后较差,药物治疗选择较少,化疗方案选择仅限于单药或者双药方案。新型靶向治疗的出现转变了这类癌症的治疗方式。近几年,妇科肿瘤最大的进展分别来自于针对卵巢癌和子宫内膜癌的 PARP 抑制剂和免疫检查点抑制剂的出现。今天邀请到了潍坊市人民医院陈芳医生解读2021年4月发表在《The British Journal of Radiology》的一篇综述《PARP抑制剂和免疫治疗在卵巢癌和子宫内膜癌中的应用》,作者来自于英国圣巴塞洛缪医院的Dr Melanie Powell。这篇文章探讨了在卵巢癌和子宫内膜癌中使用 PARP 抑制剂和免疫治疗背后的生物学原理和临床证据。


 00:000:00 音频
00:000:00 音频 1.背景
目前,多种 PARP 抑制剂已被批准作为晚期卵巢癌的一线维持治疗和铂敏感复发患者维持治疗。免疫检查点抑制剂已被证明可成功用于晚期错配修复缺陷的子宫内膜癌。
2.卵巢癌与PARP抑制剂
PARP 抑制剂选择性杀死 BRCA1/2突变肿瘤细胞的合成致死的作用机制是在肿瘤学中关键发现。大多数遗传性卵巢癌是由BRCA1 和 BRCA2 基因的突变引起的。另外约有 50%的散发性 HGOC 也通过多种机制存在HRD缺陷,并具有与 BRCA1 / 2 缺失相关的表型。
3.卵巢癌中的PARP抑制剂的应用
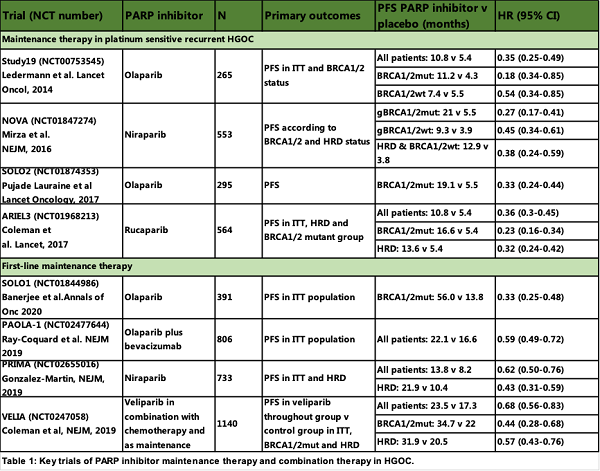
复发性卵巢癌
Study 19和SOLO2 研究证实了对 gBRCA1/2突变型 HGOC 患者的PFS 有显著改善(19.1vs 5.5 个月,HR:0.30)。
尼拉帕利(NOVA)和rucaparib(ARIEL3)观察到铂敏感性复发 BRCA1 / 2 突变 HGOC 的维持 治疗具有相似的获益(表 1)。
但NOVA 和 ARIEL3 试验同时纳入了BRCA1 / 2 野生型患者,结果均显示无论 BRCA1 / 2或HRD状态如何,所有人群均获益 (表1)。
尼拉帕利、rucaparib 和 olaparib已可用于所有铂敏感复发性卵巢癌患者的维持治疗,而不论 BRCA1 / 2 的状态如何。
一线维持治疗
多项临床研究显示从细胞减灭术和铂类化疗后早期引入 PARP 抑制剂中获得更大的获益。
研究(SOLO1,PAOLA-1,PRIMA 和 VELIA)显示:BRCA1/2突变的存在一致地预测了对 PARP 抑制剂的获益;尽管观察到的获益时间更长,其获益程度与在复发维持治疗相似(HR 范围 0.30-0.44)。
PRIMA研究显示BRCA1/2野生型/ HRD患者可从从尼拉帕利中获益,中位PFS从 8.2个月增加到 19.6 个月(HR;0.5);探索性分析显示HRP亚组有一定程度的获益(HR 0.68)。
PAOLA1 研究显示olaparib对 BRCA1 / 2 野生型/ HRD 人群获益(PFS 从 16.6 增至 28.1 个月,HR 为 0.43);但BRCA1 / 2 野生型/ HRP 人群未获益(16.0 至 16.9 个月,HR 为 0.92;)。
基于这些结果,批准了卵巢癌一线铂类化疗后对 HRD 的HGOC 进行奥拉帕利和贝伐单抗的维持治疗;对所有 HGOC 进行尼拉帕利的维持治疗。
4.卵巢癌中免疫检查点抑制剂的应用
免疫检查点抑制剂在卵巢癌中的作用尚不明确,迄今为止观察到的获益尚不多。
在经过多次既往治疗的患者中,使用单药pembrolizumab总缓解率仅为 8.5%,而在一线治疗中,在标准化疗方案联合avelumab 并没有 PFS 获益。
研究报道提示肿瘤浸润淋巴细胞(TILs)在卵巢癌中与预后相关。然后卵巢癌中的 TIL通常在功能上已耗尽,并具有高水平的 PD-1 表达,从而有助于免疫抑制性肿瘤微环境。
卵巢癌被归类为 TMB 低且 T 细胞浸润不足的“冷肿瘤”。这些可能部分解释了免疫治疗单药治疗响应率低的原因。因此,有必要确定最佳的联合治疗以提高临床缓解率。
5.子宫内膜癌和免疫检查点抑制剂
癌症基因组图谱根据突变负荷,体细胞拷贝数变化和特定的驱动突变定义子宫内膜癌为四组:聚合酶-? (POLE)突变、MMR缺陷(MMRd)驱动的微卫星不稳定、低拷贝数和高拷贝数体细胞突变(常有TP53突变)。
POLE 突变和 MMRd 肿瘤与高水平的肿瘤浸润淋巴细胞相关,并具有高肿瘤突变负荷和免疫检查点基因的表达增加,这使其成为免疫检查点抑制剂的潜在靶标。
6.晚期或复发性子宫内膜癌的免疫检查点抑制剂应用
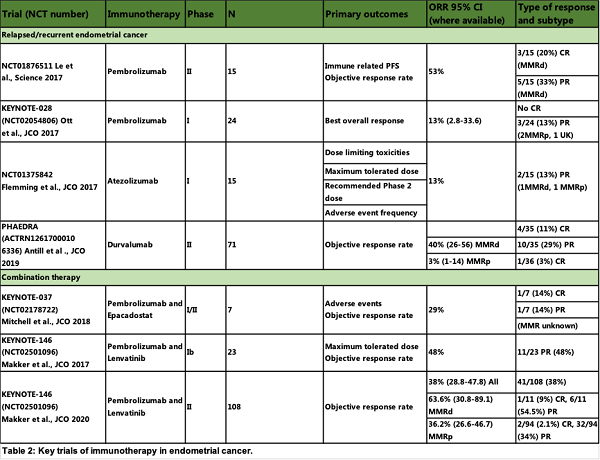
在一项小规模的初步研究显示Pembrolizumab在MMRd肿瘤中的有效性和安全性,在 15 例子宫内膜癌患者中,有 8 例(53%)表现出一定的缓解。
KEYNOTE-028 研究探索了 Pembrolizumab 在患有晚期或转移性子宫内膜癌的 PD-L1 阳性患者中的疗效,3例患者(13%)达到部分缓解。
根据这些结果以及pembrozulimab其它在MMRd 肿瘤的研究,FDA 批准了pembrozulimab用于标准治疗后进展的MMRd肿瘤。
Atezolizumab在复发性子宫内膜癌的 I 期研究,总缓解率为 13%(2/15),两名患者达到PR。其中,一名患者为 MMRd,而另一名患者为 MMRp;这表明 MMR状态可能不是对免疫治疗的反应起到关键性的。
Durvalumab已被证明对晚期子宫内膜癌患者有效;在MMRd组,总有效率为40% (14/35), MMRp中只有一例观察到缓解(PR) (3%)。(表2)
7.子宫内膜癌中免疫检查点抑制剂联合药物治疗
目前在研的是 Pembrolizumab与Lenvatinib的联合。
该联合在早期试验中,在 23 名患者中有 11 名(48%)出现了PR。一项单臂2期研究结果显示108 人中有 41 人(38%)显示在 24 周内有客观缓解。(表2)
FDA 批准使用 Pembrolizumab联合Lenvatinib 来治疗该患者在先前的全身治疗后仍有疾病进展且无治疗方案选择的的非MSI-H 或 MMRd 晚期子宫内膜癌的患者。2021年SGO更新了KEYNOTE-775研究:Lenvatinib联合Pembrolizumab方案可显著改善含铂化疗治疗后进展的子宫内膜癌患者OS,PFS和ORR,且任何MMR状态均可获益。
肿瘤逃避免疫系统识别的一种潜在途径被认为是吲哚胺 2,3-脱氧酶 1(IDO1)酶的上调。
IDO1酶的抑制剂(如Epacadostat)与 Pembrolizumab 联合使用已在1期试验中,以研究可能的加性效应。(表2)
8.子宫内膜癌免疫检查点抑制剂联合放疗
通过免疫启动放疗可以加强放疗部位的局部肿瘤控制。据推测放疗释放肿瘤新抗原,激活细胞毒性T细胞,进而迁移到受辐射和非辐射的肿瘤细胞,产生免疫介导的肿瘤细胞死亡。
研究显示:在接受 nivolumab 的患者经历了多个疗程的姑息放疗后,在辐射范围内和辐射范围外远处病灶观察到了疾病缓解。
9.免疫检查点抑制剂联合PARP抑制剂
尽管HRD通常与BRCA1/2突变有关,但许多其他基因也发挥了重要作用,比如子宫内膜癌中突变频率较高的ARID1A基因和P53基因突变。
PARP抑制剂与免疫检查点抑制剂的联合基本原理基于两个假设:首先,DNA修复缺陷的肿瘤,如HRD肿瘤,会增加肿瘤突变负荷,导致更高的新抗原负荷,从而刺激机体来增强抗肿瘤免疫反应。其次,PARP抑制上调PD-L1表达,在BRCA通路功能缺失的情况下,通过STING通路激活先天免疫反应,这可能会增强PARP抑制剂联合免疫治疗的疗效。
10.结论
PARP抑制剂治疗晚期卵巢癌和免疫检查点抑制剂治疗MMRd晚期子宫内膜癌可显著改善预后,并观察到有意义的临床获益。通过靶向肿瘤的特定的分子和基因特征来进行个体化治疗越来越多地纳入到标准治疗当中,使我们能够准确地为每个患者选择最合适的治疗方法。
通过这种方法,我们正在从“一刀切‘’治疗方法转为了个体化的方法,这将会改善患者生存结局。我们在卵巢癌和子宫内膜癌的治疗取得了很大的进步,但仍有一些人群的治疗需求未得到满足,例如HRP卵巢癌人群或PARP抑制剂治疗后进展的卵巢癌。同样,虽然在高拷贝数和没有特定分子谱的子宫内膜癌患者中观察到了免疫检查点抑制剂的临床效果,但我们认为这些疗效还是有限的,后续仍需努力为这类患者群探索更好的治疗模式。
参考文献:
RE Miller, A Lewis, ME Powell.PARP inhibitors and immunotherapy in ovarian and endometrial cancers.Br J Radiol. 2021 Apr 21;20210002. doi: 10.1259/bjr.20210002. Online ahead of print. PMID: 33882241 DOI: 10.1259/bjr.20210002

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
