各位妇瘤同仁大家好,欢迎收听本期OC文献精读,我是今天的领读人,来自四川大学华西第二医院的周圣涛医生,今天与大家分享的文章是我们课题组、美国加利福尼亚大学Jeremy N Rich和华西医院汪源课题组于2021年2月刊登在《SCIENCE ADVANCES》杂志的文章:浆细胞通过转运外泌体microRNA建立卵巢癌的间充质特性。


 00:000:00 音频
00:000:00 音频 卵巢癌,主要是高级别浆液性卵巢癌(HGSC),是一种高度致死性疾病,对女性造成沉重负担。在肿瘤生物学和临床结果中表现出很大的异质性。来自肿瘤患者标本的大规模转录谱分析已成为HGSC分子亚型寻找的开创性工作方法。HGSC目前公认的分子分型,源于癌症基因组图谱(TCGA) 2011年的一项研究。该项目依据近500例浆液性卵巢癌患者样本将HGSC依据转录组数据分为四种不同的亚型:免疫反应型、增殖型、分化型和间充质型,每种亚型的预后和对治疗的响应不同,其中间充质型的预后最差。因此,针对性研究间质型卵巢癌细胞的分子特征、形成机制和调控机制成为领域内研究的热点。
肿瘤样本的分子分型通常由肿瘤细胞本身和肿瘤微环境细胞共同决定。近年来,肿瘤微环境细胞中的浸润性免疫细胞获得了非常多的关注,因为肿瘤中浸润的免疫细胞对肿瘤微环境的贡献非常大,能够影响肿瘤的状态和生物学功能,包括肿瘤发生发展速度、肿瘤迁移、耐药性等指标,有望成为新的免疫治疗靶点。对这些细胞透彻的研究能够帮助我们预测临床预后和对各种治疗手段的响应,包括对放化疗、免疫疗法等的响应。然而,鲜有报道不同亚型的卵巢癌是否表现出不同的免疫浸润模式,这对于HGSC的精确医学诊疗至关重要。
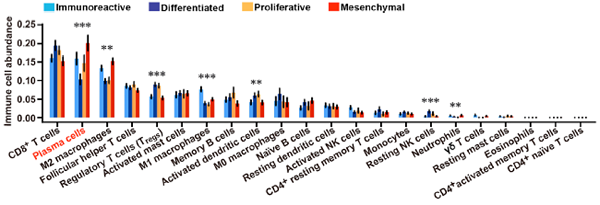
图1(A)
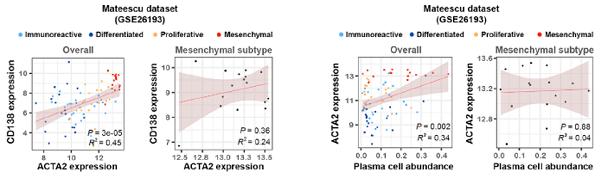
图1(B)
图1:(A) 多种免疫浸润细胞在四种经典转录组亚型的卵巢癌中的丰度差异。(B) 浆细胞在间充质型卵巢癌中特异富集。
我们的研究发现,浆细胞在间充质型卵巢癌中富集,并通过外泌体miR-330-3p增强周围肿瘤的间充质表型。 我们认为,整个肿瘤标本中转录组特征的去卷积分析可以区分肿瘤和免疫细胞的贡献,并有助于深入了解卵巢癌中各亚型特异性的免疫反应。本研究中的基因表达去卷积算法(CIBERSORT)预测了免疫细胞的22个不同功能子集的相对比例。我们使用这种方法对HGSC的四种亚型的免疫浸润进行了定量,发现其与亚型之间存在显著相关性。通过使用这种集成的计算分析以及进一步的功能实验,我们确定了一种免疫相关的细胞——浆细胞,及其分子和临床网络,突出了浆细胞在HGSC的间充质表型的重要作用。研究证明,浆细胞是产生抗体的B细胞的子集,在HGSCs的间充质亚型中富集。HGSCs临床标本中的浆细胞丰度与间充质细胞密度相关。非间充质型的卵巢癌细胞和浆细胞的共培养,在体外可以诱导肿瘤细胞的间充质表型。这种表型转换是由于含有miR-330-3p的浆细胞来源的外泌体转移到了非间充质型卵巢癌细胞中。外泌体来源的miR-330-3p以非经典调控模式增加了连接黏附分子B的表达。硼替佐米(BTZ)——一种对浆细胞有一定特异抑制作用的药物处理荷瘤小鼠,抑瘤效果较为明显。此外,我们通过体外实验证明浆细胞比卵巢癌细胞对BTZ的敏感性更高,提示BTZ可能主要通过抑制浆细胞来抑制肿瘤。
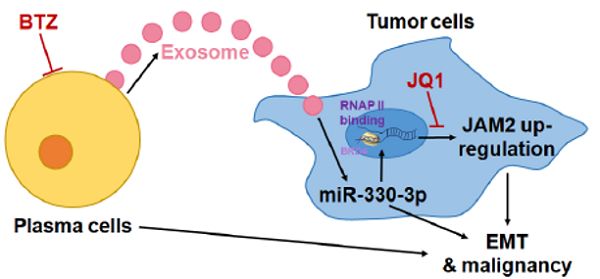
图2:浆细胞通过外泌体介导的miR-330-3p 促进卵巢癌发展及间充质转化模式图。
本研究的局限性在于反向证明实验中使用的抑制剂BTZ对浆细胞的抑制特异性不够强。在未来的研究中,研究者可使用SDC1基因敲除鼠异种移植卵巢癌模型,进一步证明浆细胞对卵巢癌的促进作用。
总之,我们的这项工作表明靶向浆细胞可能是阻止非间质型卵巢癌进展和发生间充质转化的一种新方法。硼替佐米对浆细胞的消耗逆转了卵巢癌的间充质特性,并抑制了体内肿瘤的生长。
以上是我今天分享给大家的全部内容,感谢聆听。OC文献精读每周二与您相约,下周二再会!
参考文献:Yang Z, Wang W, Zhao L, Wang X, Gimple RC, Xu L, Wang Y, Rich JN, Zhou S. Plasma cells shape the mesenchymal identity of ovarian cancers through transfer of exosome-derived microRNAs. Sci Adv. 2021 Feb 24;7(9):eabb0737. doi: 10.1126/sciadv.abb0737. PMID: 33627414; PMCID: PMC7904265.
附:英文摘要
Plasma cells shape the mesenchymal identity of ovarian cancers through transfer of exosome-derived microRNAs
Zhengnan Yang, Wei Wang, Linjie Zhao, Xin Wang, Ryan C. Gimple, Lian Xu, Yuan Wang, Jeremy N. Rich, Shengtao Zhou
Abstract:Ovarian cancer represents a highly lethal disease that poses a substantial burden for females, with four main molecular subtypes carrying distinct clinical outcomes. Here, we demonstrated that plasma cells, a subset of antibody-producing B cells, were enriched in the mesenchymal subtype of high-grade serous ovarian cancers (HGSCs). Plasma cell abundance correlated with the density of mesenchymal cells in clinical specimens of HGSCs. Coculture of nonmesenchymal ovarian cancer cells and plasma cells induced a mesenchymal phenotype of tumor cells in vitro and in vivo. Phenotypic switch was mediated by the transfer of plasma cell–derived exosomes containing miR-330-3p into nonmesenchymal ovarian cancer cells. Exosome-derived miR-330-3p increased expression of junctional adhesion molecule B in a noncanonical fashion. Depletion of plasma cells by bortezomib reversed the mesenchymal characteristics of ovarian cancer and inhibited in vivo tumor growth. Collectively, our work suggests targeting plasma cells may be a novel approach for ovarian cancer therapy.
Keywords:Ovarian cancer, plasma cells, mesenchymal phenotypes, cancer metastasis, exosomes, microRNA.

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
