本期特别邀请来自湖北省肿瘤医院的黄奕教授解读2020年10月刊登在Seminars in Cancer Biology杂志的一篇题为《Genomic profiling of platinum-resistant ovarian cancer: The road into druggable targets》的文章(IF:11.09)。该文章主要综述了铂诱导的DNA损伤修复的途径及其与高级别浆液性卵巢癌基因组改变的关系,以及针对这些改变的新的治疗策略。

黄奕 教授
主任医师
湖北省肿瘤医院妇科主任医师,副主任
中国抗癌协会妇科肿瘤专业委员会常委
中国抗癌协会近距离放射治疗专业委员会常委
中国医师协会放射肿瘤治疗医师分会近距离治疗学组委员
湖北省抗癌协会理事会理事
湖北省抗癌协会妇科肿瘤专业委员会副主任委员
湖北省妇幼保健协会妇科微创专业委员会常委
湖北省医学会妇产科分会委员

 00:000:00 音频
00:000:00 音频 调查显示,卵巢癌是死亡率最高的妇科恶性肿瘤。自20世纪80年代以来,铂类药物一直是卵巢癌治疗的重要药物。高级别浆液性癌(HGSC)是卵巢癌最常见的组织学亚型,它在初始治疗时是一种对铂高度敏感的肿瘤,但近90%的Ⅲ期患者在5年内复发,最终将出现铂耐药。了解铂类药物的作用及耐药机制,有助于确定是否能再次选用铂类药物治疗,并能指导新的治疗抉择。
1、铂耐药的机制
铂类药物的作用机制是:铂可与DNA结合形成链内加合物、链内或链间交联,通过ATR和p53激活DNA损伤效应,进而导致细胞周期停滞和细胞凋亡的激活。
以往铂耐药的定义是指最后一次含铂治疗与复发之间的时间间隔小于6个月,出现铂耐药的患者,通常不再推荐含铂治疗。铂耐药可能的两种主要机制为:一、通过改变细胞的药理作用抑制铂-DNA加合物的形成,二、减少DNA损伤后细胞死亡。(图1)。
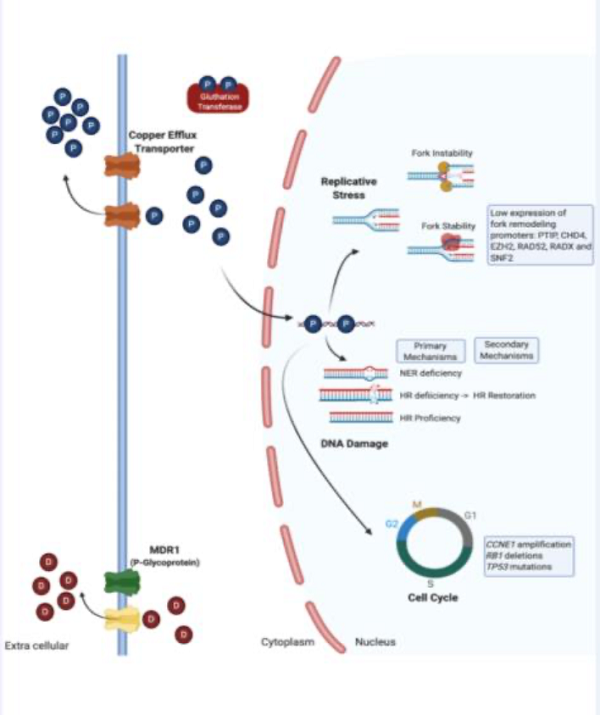
图1:铂作用示意图 可以确定治疗敏感性的点
“P” 指由铜外流转运体转运到细胞外的铂,“D” 指由MDR1蛋白输出到细胞外的其它药物
2、针对铂耐药的对策
01、防止铂-DNA加合物的形成
铂外流是由铜外流转运蛋白ATP7A和ATP7B10介导的。最近,人们正在努力寻找能够特异性抑制肿瘤细胞的ATP7B功能的药物,以克服这种铂耐药机制。两性霉素B、曲尼司特和替米沙坦被确定为潜在药物,但仅有初步证据。
另一种阻止DNA损伤的方法是中和细胞浆中的铂。细胞内的谷胱甘肽水平与铂敏感性有关,而谷胱甘肽转移酶与铂耐药有关,因为它具有分离和灭活铂的能力。它们成为肿瘤治疗时诱导铂敏感性的潜在靶点。
最近在卵巢癌中,一种药物外排泵被重新引起关注,它是ABCB1转运体,也被称为p-糖蛋白,由多药耐药1 (MDR1)基因编码。虽然铂不是p-糖蛋白的底物,但大多数用于治疗卵巢癌患者的其它药物如紫杉类、脂质体阿霉素、拓扑替康以及PARP抑制剂是p -糖蛋白的底物,这些药物的耐药性与p -糖蛋白的表达有关。
02、DNA损伤后阻止细胞死亡
正常的细胞增殖和DNA完整性的维护涉及细胞周期的网络中复杂的相互作用和冗余机制。细胞周期受到初始的DNA损伤应答(DDR)效应的调控,DDR将启动DNA修复途径、细胞周期调控和复制应激效应。细胞周期的异常在许多癌症中都很常见,其中一些可能使铂导致的DNA受损后的自我修复或耐受能力增强,从而引发铂耐药。图2显示了DNA修复通路的主要途径与步骤;图3显示了针对双链断裂的DNA修复通路及其调控机制。
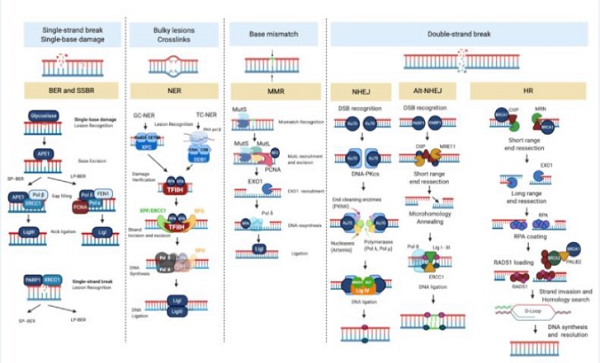
图2:DNA修复通路的主要途径与步骤
NER,核苷酸切除修复; MMR,错配修复; NHEJ,非同源末端连接; Alt-NHEJ,选择性非同源末端连接,也称为微同源修复(microhomology repair, MMEJ); HR,同源重组。
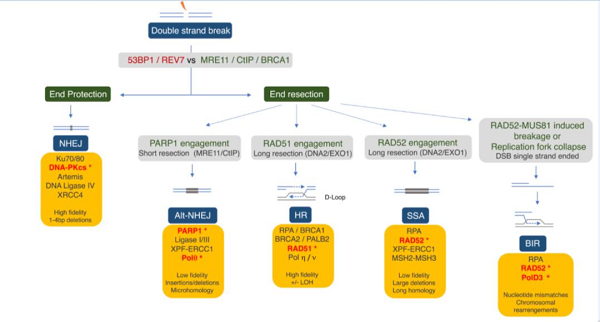
图3 针对双链断裂的DNA修复通路及调控机制
NHEJ,非同源末端连接; Alt-NHEJ,选择性非同源末端连接; HR,同源重组; SSA,单链退火;BIR, 断链感应修复. *针对该蛋白抑制剂正在研发中。
针对不同的耐药机制,有相应的作用靶点,表1中显示了正在进行的研究。
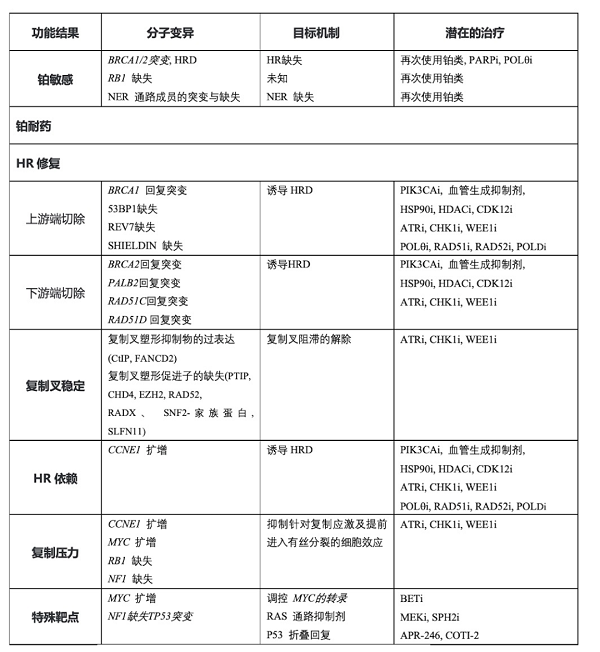
表1:针对铂耐药复发的基因组的改变的可采取的治疗
03、高级别浆液性卵巢癌(HGSC)的基因组改变和新的治疗策略
HGSC的特征是低频率的频发突变,低到中等的突变肿瘤负荷,高度的基因组不稳定性和高频率的基因组结构变异,如拷贝数变异(CNVs)和杂合性缺失(LOH)。几乎所有HGSC都存在TP53体细胞突变,15%至25%的病例存在胚系BRCA1或BRCA2突变,约7%至8%的病例存在BRCA1或BRCA2体细胞突变。其他频发突变的基因有RB1、NF1、FAT3、CSMD3、GABRA6和CDK12。最常被扩增的基因是CCNE1(编码细胞周期蛋白 E1的基因)、MYC和MECOM,见于在20%以上的患者。至少10%的患者中存在MAPK1和KRAS的扩增。最常见的基因缺失是RB1、NF1和PTEN。基因组的高度不稳定性归结于TP53突变的普遍存在和HR DNA修复通路的频繁改变(图4)。
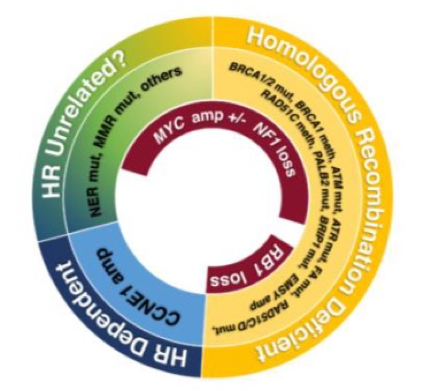
图4 卵巢高级别浆液性癌的基因组特征。
注:HR,同源重组;NER,核苷酸切除修复;MMR,错配修复;mut,突变;meth,甲基化;amp,放大
(1)TP53
目前有一些针对p53突变蛋白的小分子正在研究中。第一类分子可与p53突变蛋白结合,促进正常折叠和恢复p53功能。其中APR-246是一种半胱氨酸结合化合物,与卡铂和脂质体阿霉素联用治疗卵巢癌患者的Ib期临床研究正在进行中。在23例患者中,总有效率为74%,但主要见于铂敏感患者中。在铂耐药卵巢癌中,APR-246联合脂质体阿霉素的II期研究已经完成,结果正在等待中(clinicaltrials.gov, NCT03268382)。COTI-2是一种Zn2+螯合剂,也能促进突变型p53的适当折叠,并具有一定的抑制PI3K活性的能力。COTI-2已经在不同的细胞系中显示出活性,目前正在进行I期临床试验。第二类小分子是破坏p53突变聚合物。Reacp53将这些聚合物转化为“野生型”p53,目前仍处于临床前研发阶段。最后,针对LoF无义突变的治疗更为困难,因为该基因产物是一个被截断的蛋白质。诱导转录通道和抑制突变mRNA降解的方法正在研究中。
(2)同源重组修复缺陷
a.BRCA1和BRCA2突变
对携带BRCA突变的铂耐药复发的患者,使用PARPi可获得30% - 40%的缓解率,因此,PARPi被批准用于携带BRCA1或BRCA2突变的肿瘤患者的治疗。在一项针对携带BRCA突变的铂耐药患者的II期研究中,比较了使用PARP抑制剂和脂质体阿霉素的疗效,PARP抑制剂的缓解率为31%,化疗的缓解率为18%,尽管二者差异没有统计学意义,但PARP抑制剂缓解率相对更高。因此我们推测,铂耐药的患者当携带BRCA1或BRCA2突变时,可选用PARP抑制剂治疗代替化疗。
b.其他可能与HRD相关的基因组改变
大约50%的卵巢HGSC中存在HRD,BRCA1或BRCA2胚系或体细胞突变的以外的原因包括BRCA1基因启动子的甲基化(~ 10%), EMSY的扩增(~ 8%), PTEN的缺失与突变(~ 7%),RAD51C的甲基化(3%)、ATM或ATR的突变 (~ 2%), CDK12突变(~ 3%),和其他HR/ FA途径基因的突变,如brp1、RAD51C、RAD51D、PALB2、BARD1 (~5%)等。考虑到这些基因中的每一个都有多种不同的功能,可以预期,每一个基因的改变都可能导致不同后果。因此,寻找HRD肿瘤的另一种方法是评估HRD的后果而不是其原因,可通过识别HRD细胞的特殊的基因组结构改变来完成的,后者被称为“基因瘢痕”。
c.与HR相关的继发耐药机制和其他合成致死途径
HR恢复和复制叉稳定是与铂类药物、PARP抑制剂的继发耐药相关的DNA修复和复制应激效应的主要机制。
HR恢复:与铂耐药相关的最常见的HR恢复机制是HR基因的二次突变。在33% ~ 46%的铂耐药肿瘤或是循环肿瘤DNA (ctDNA) 中可发现BRCA1或BRCA2的二次突变。DSBs(DNA双链断裂)末端切除的调控因子的表达缺失也可能恢复HR通路。抑制PI3K可下调BRCA1表达,上调PARP和H2AX磷酸化,减少RAD51粒的形成,导致HR缺陷。PI3K抑制剂(clinicaltrials.gov, NCT 03586661)和Akt抑制剂(clinicaltrials. gov, NCT 02208375)联合PARP抑制剂的前期试验在无HRD的患者中显示有效。
VEGFR抑制剂可能通过缺氧下调BRCA和RAD51的表达以及通过直接调控E2F4诱导HRD。至少有两项随机试验评估了联用抗血管生成药物与PARP的效果,并提示对野生型BRCA1和BRCA2肿瘤患者的益处更明显,这表明抗血管生成药物可能增加细胞对PARP抑制剂的敏感性。其他抑制HSP90、组蛋白去乙酰化酶(HDAC)和CDK12的药物尚未取得有力的证据。
复制叉稳定:保护复制叉免受溶核降解,是与BRCA无关的、获得性耐药的另一个可能机制。可通过增加复制叉重塑的负性调控因子如CtIP和FANCD2的表达,或减少促进复制叉重塑的蛋白如PTIP、CHD4、EZH2、RAD52、RADX和snf2家族蛋白(ZBRANB3、SMARCAL1和HTLF)的表达来实现。另一种克服PARP抑制剂和铂耐药的方法,是在促进HRD的同时,针对复制应激和复制叉稳定采取措施。复制应激效应是由G2/M和S期细胞周期检查点驱动的。在临床前研究中,抑制ATR、Chk1和Wee1可促使分叉不稳定,解除G2/M细胞周期阻滞,诱导HRD与PARP抑制剂产生协同作用。ATR、Chk1和Wee1抑制剂处于更晚一些的临床研发阶段。其他针对铂/PARP抑制剂耐药或HRD肿瘤继发耐药的策略正处于早期研发阶段。研究的靶点包括alt-NHEJ、RAD51、RAD52等。
HGSC的基因改变还包括CCNE1扩增、MYC扩增、RB1缺失、NF1缺失、NER缺陷、ABCB1融合等,目前尚未取得突破性的进展。
除了铂耐药的应对策略,文章还综述了其他相关进展,包括突变和结构基因组变异的特征、DNA甲基化、基因表达谱的分子亚型、免疫遗传概况、肿瘤的异质性、肿瘤的进化和肿瘤取样的时机等,由于篇幅限制就不一一复述。
3.结束语
总体来说,HGSC的主要特征是DNA修复通路和细胞周期调节因子的改变,而耐药具有异质性,可能是原有的特性,也可能是由治疗诱导的代偿机制所致。基因组特征是一个重要的信息来源,可以了解针对耐药的潜在的治疗靶点,并指导新的治疗策略。单一的基因组改变不能解释所有的临床现象,应深入了解同时出现的不同的基因组改变及其功能间的相互作用,这将有助于确定哪些患者将从个体化的治疗中受益最大。

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
