各位妇瘤同仁大家好,欢迎收听本期OC文献精读,我是今天的领读人,来自空军军医大学附属西京医院的刘淑娟医生,今天与大家分享的文章是2020年8月刊登在《Clin Cancer Res》杂志的文章:PARPi after PARPi耐药机制探讨:西地尼布联合奥拉帕利治疗PARP抑制剂进展后卵巢癌:一项多中心开放标签单臂临床和转化II期临床试验。

刘淑娟 教授
主任医师、博士生导师
西京医院妇产科主任医师
科室副主任、博士生导师
医学博士、牛津大学John Radicliff医院博士后
中国抗癌协会妇科肿瘤专业委员会委员
陕西省抗癌协会宫颈癌防治专业委员会主任委员
中国优生协会肿瘤生殖分会常委
“AUB临床规范化管理项目”全国专家讲师
主持国家自然科学基金3项,陕西省重点课题1项,参与多项国家自然科学基金课题9项,发表论文30余篇,SCI论?20篇。其中第一/通讯作者SCI论文13篇,最高影响因子9.28。参编牛津大学出版社英文教科书《Textbook of oncology》,副主编及参编国内著作4部。获陕西省科技进步二等奖,军队医疗成果三等奖

 00:000:00 音频
00:000:00 音频 文章概述
卵巢癌中最常见的类型是高级别浆液性卵巢癌(HGSOC),其特征是严重的基因组不稳定,几乎普遍的TP53突变导致P53功能障碍,以及约一半患者存在DNA同源重组修复缺陷。目前研究正在将PARPi的使用到一线治疗当中,但没有证据表明PARP抑制剂使用疾病进展后的再次使用是有效的。在临床前环境中已经描述了几种耐药机制,但尚未系统评估其临床相关性。全世界范围内目前仅有2019年SGO报道了22例患者使用PARP抑制剂进展后再次使用PARP抑制剂的数据,EVOLVE是一项由研究者发起的II期研究,旨在评估西地尼布-奥拉帕利在PARPi治疗进展后的HGSOC的有效性和安全性(无论BRCA状态如何)。
这项二期研究(NCT02681237)在加拿大和西班牙的两个中心进行,队列中包括PARPi治疗后进展并在随后的化疗中再次进展的患者口服奥拉帕利_西地尼布。在该研究中,五名患者在PARPi进展时出现BRCA1/2逆转突变,这与不良预后相关。然而,根据该研究设计,无法辨别这种耐药机制是在铂治疗期间获得的还是由于PARPi使用而获得的,研究设计所限,无法取得每个治疗阶段的样本组织。多药外排泵基因ABCB1的上调预示着PFS和OS更差。RAD51C过表达可能导致获得性PARPi耐药。这些同源重组基因逆转突变导致预后不良,并且不能通过在奥拉帕利中加入西地尼布来克服。
该研究还显示,在PARPi治疗后环境中,基因融合转录物的负担增加,这表明这些肿瘤的基因组不稳定性增强。该研究的主要局限性之一是样本量小,但也是目前最大的前瞻性转化研究,具有成对的档案和基线活检样本,描述了PARPi治疗后的耐药机制。这些结果值得在更大的前瞻性试验中进一步探索。这项研究的发现也可能受到肿瘤异质性的影响,PARPi后的活检部位是进行性病变。西地尼布-奥拉帕利联合用药对PARPi失败后的卵巢癌患者有一定的疗效。同源重组基因逆转突变和/或ABCB1上调的患者,可能应该考虑其他选择。
研究方法
本研究招募了经组织学证实诊断为复发性卵巢、输卵管或原发性腹膜癌的妇女,具有高级别的浆液性或高级别的子宫内膜样组织学特征,并通过影像学记录任何PARPi治疗后的疾病进展。根据铂敏感状态,患者被分成三个队列:铂敏感、铂耐药或探索性队列(包括PARPi治疗后进展并在随后的化疗中再次进展的患者,无论铂敏感状态如何)。口服奥拉帕利 300 mg,b.i.d 和口服西地尼布20 mg,QD,每28天重复一次。每8周根据RECIST v1.1评估肿瘤,直到影像学进展。强制性提供档案组织(初始诊断组织,PARPi前)和基线活检(PARPi后)样本;疾病进展时的活检是可选的。
主要终点是8周的客观缓解率ORR和16周的PFS。次要终点是评估疾病控制率、安全性和对PARPis的耐药机制。
结果
2016年6月至2018年10月,34名女性入选(铂敏感队列n = 11耐铂药队列n = 10探索队列n = 13)。所有患者都患有HGSOC,62%有体系和/或胚系BRCA1/2突变(表1)。患者前线接受过五线治疗。6名患者(18%)接受了两线相同的PARPi治疗(奥拉帕利 n = 4;尼拉帕利 n = 2)和6名患者(18%)曾接受过抗血管生成治疗(贝伐单抗n = 5,西地尼布 n = 1)。
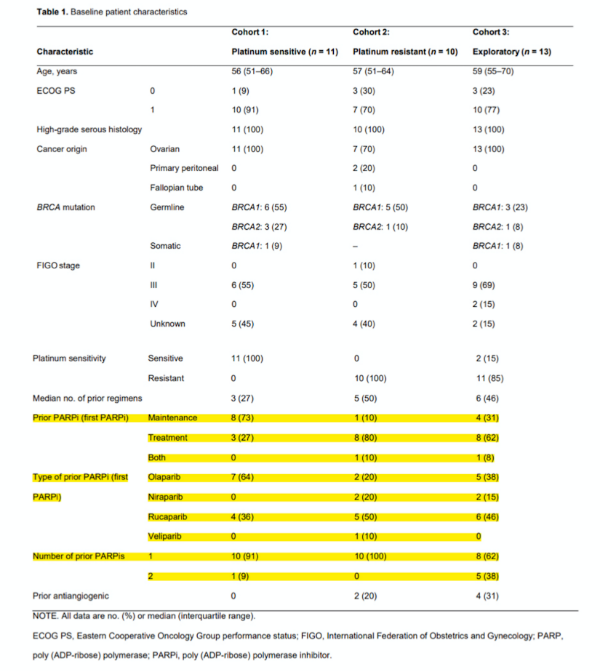
表1:入组患者基线特征
数据截止日(2019年6月24日),随访的中位持续时间为11.6个月;31名患者已完成治疗,3名仍在接受治疗(图1)。
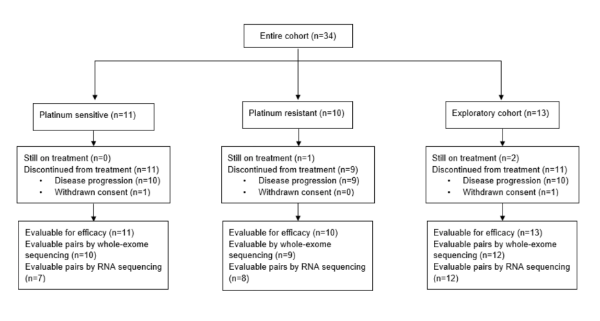
图1:试验流程
目标应答率在铂敏感队列中为0%,在铂耐药队列中为20%,在探索队列中为8%(表2)。相应的16周PFS分别为55%、50%和39%。
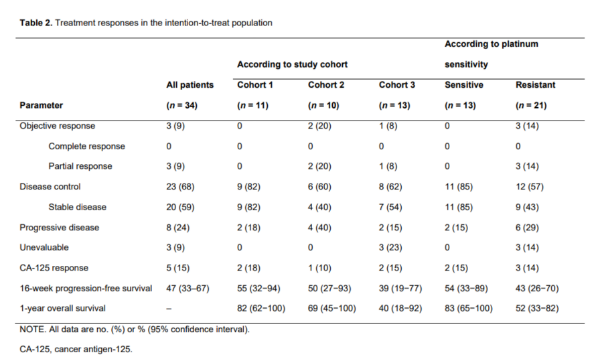
表2:意向治疗人群的治疗应答
治疗耐受性良好,不良反应(AE)符合预期。最常见的不良反应是腹泻(68%)、恶心(53%)、疲劳(44%)和呕吐(44%),通常为1/2级(表3)。总体而言,38%的患者出现3级不良事件,最常见的是腹泻(12%)和贫血(9%)。胚系BRCA1突变的患者中有一个4级AE(骨髓增生异常综合征;之前的治疗包括两个含铂化疗方案和21个月的奥拉帕利维持治疗),没有5级不良反应。
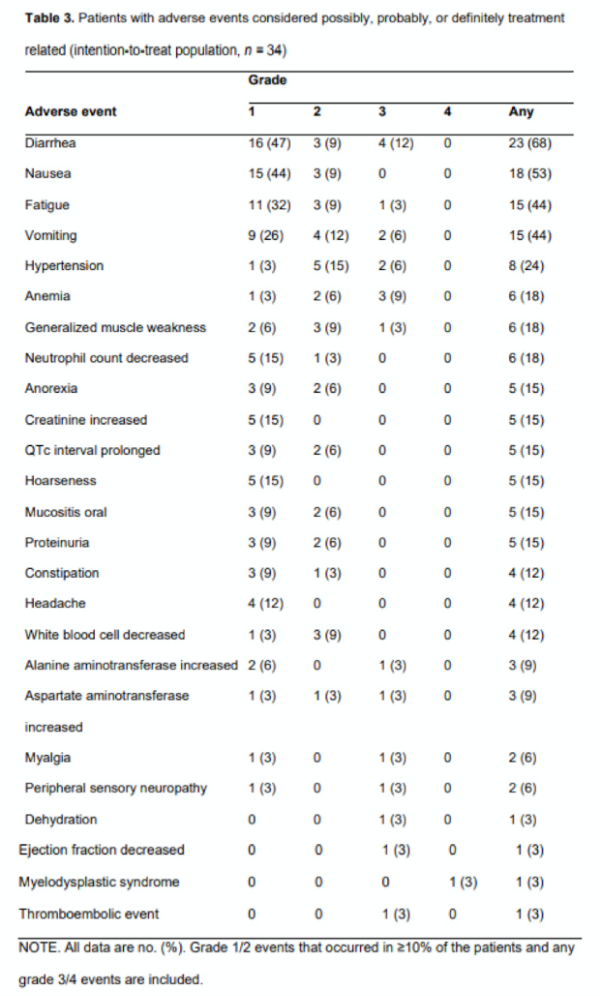
表3:可能与治疗相关的不良反应
外显子组数据来自33名患者的档案样本(PARPi前),32名患者的基线样本(PARPi后),以及31名患者的配对的档案和基线样本。这个配对样本队列用于研究获得性耐药机制。成对的档案和基线RNA测序数据(n = 27)用于检查基因表达的变化。
在30/33档案样本中检测到TP53变异体(29/31配对;图2),与HGSOC组织学一致。病理检查证实了TP53阴性病例的高级浆液形态。TP53位点也被人工审查,以排除假阴性。21名患者有BRCA1/2突变(表1);其中,20个含有截短的BRCA1/2变异体,其中5个(2个铂敏感,3个铂耐药)在匹配的进展性肿瘤中有二级逆转突变(图2)。
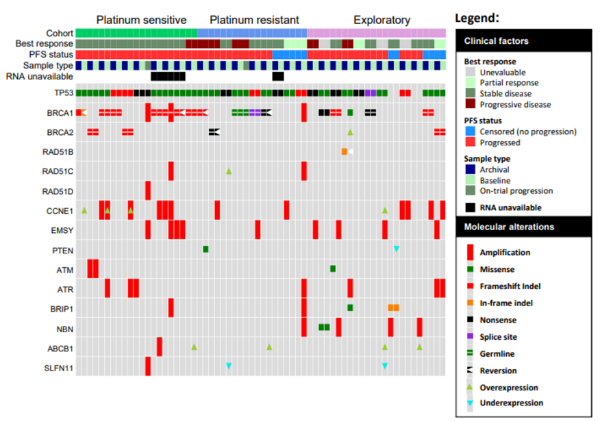
图2:PARP抑制剂耐药的获得性机制
在外显子组测序涵盖的17个同源重组缺陷基因(ATM,ATR,EMSY,BRIP1,CHEK1,CHEK2,RAD50,RAD51C,RAD51D,BRIP1,BARD1,RAD50,FAM175A,NBN,PALB2,PTEN和MRE11),本研究的研究者们观察到一个单一的RAD51B突变逆转,在档案标本中检测到的18 bp框内缺失在基线样本中未检测到。总的来说,同源重组基因(BRCA1/2或RAD51B)逆转的患者表现出明显差于突变或野生型同源重组基因的患者(分别为4.8和6.4个月)(图3)。由于疾病进展,BRCA1/2逆转的患者总是提前停止治疗(从开始治疗起2个月内)(图4)。我们还在三个基线样本中观察到BRCA1/2扩增或过表达,表明同源重组缺陷的功能恢复;这与治疗反应无关(图4)。此外,其他同源重组基因的表达随时间而变化。对其他已知的PARPi耐药内源或获得性机制的检查显示,11/31配对病例中有CCNE1扩增/过表达(档案和基线配对组各3例,基线组7例,档案组1例)(图2)。我们还回顾了BRCA1/2突变病例中TP53BP1功能的丧失,以及基线与档案样本中ABCB1、SLFN11和DYNLL1表达的扰动。虽然没有检测到TP53BP1和DYNLL1丢失,但ABCB1在四个基线样本中过表达,在一个样本中扩增,而SLFN11在两个基线样本中显著下调。在这项研究中,在55%可评估的进展性肿瘤中检测到先前描述或提出的PARPi耐药机制。在所有三个队列的机制分布相似(图2)。多药外排泵基因ABCB1的上调预示着PFS和OS更差(图3)。
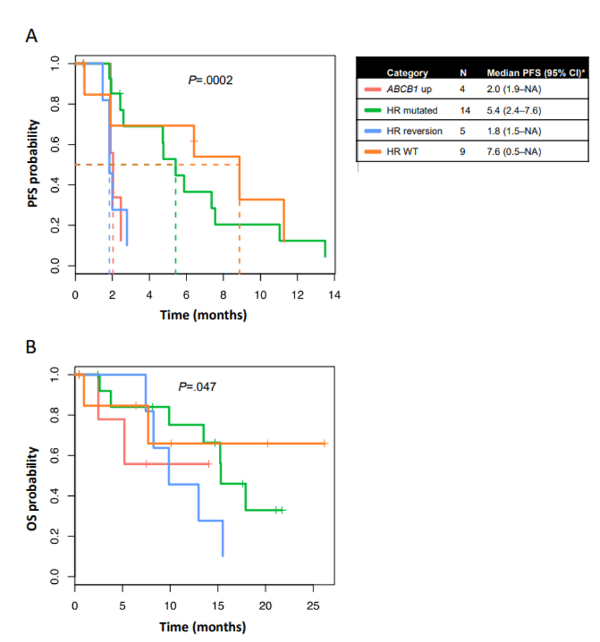
图3:根据突变状态患者的疗效
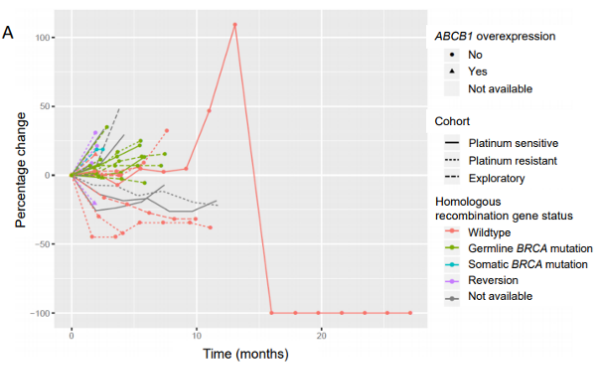
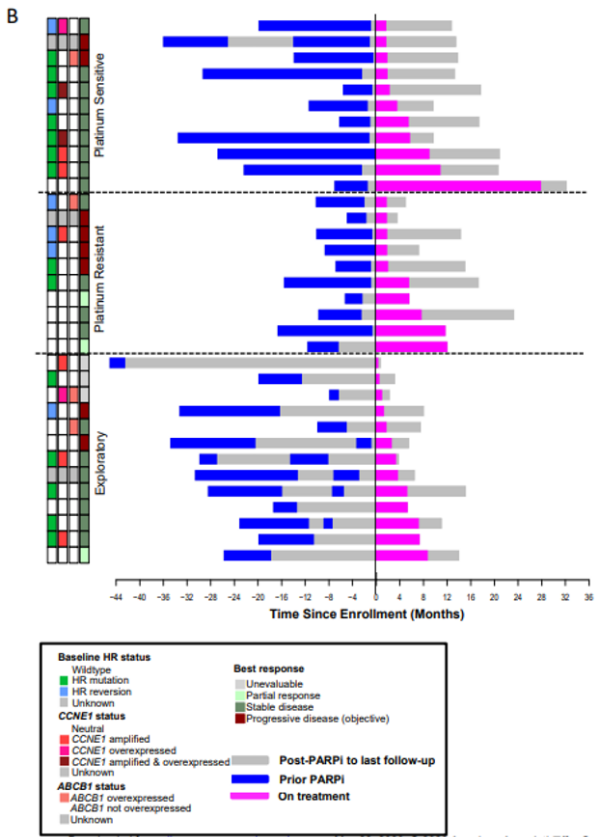
图4:PARP抑制剂耐药机制映射到临床结果
讨论
在该研究中,五名患者在PARPi进展时出现BRCA1/2逆转突变,这与不良预后相关。然而,根据该研究设计,无法辨别这种耐药机制是在铂治疗期间获得的还是由于PARPi而获得的,因为PARPi前样本是档案组织。在EVOLVE中,在一个后期进展样本中观察到RAD51B逆转突变。有趣的是,RAD51C在基线活检样本中显著过表达。临床前证据表明,RAD51C缺陷的癌细胞对PARPi敏感 和RAD51C过度动子超甲基化的缺失可能导致PARPi耐药。因此,在EVOLVE研究中看到的RAD51C过表达可能导致获得性PARPi耐药。
高级别浆液性卵巢癌中,这些获得性耐药机制与同源重组基因BRCA1/2和RAD51的逆转突变一起,有效地恢复了同源重组DNA修复,并诱导对PARPis和铂的临床耐药性。这些耐药机制可以在铂和PARPi之间共享。该研究表明,这些同源重组基因逆转突变导致预后不良,并且不能通过在奥拉帕利中加入西地尼布来克服。作者建议将DNA同源重组修复基因中逆转突变的检测纳入患者选择或作为未来PARPi后临床试验的分层因素。随着液体活检在临床实践中的成功应用,对逆转突变的循环肿瘤DNA分析和同源重组缺陷基因的潜在启动子甲基化应该是疾病监测和新兴耐药克隆的早期管理有价值的工具。
对PARPis耐药的另一种获得性机制包括上调由基因编码的药物外排泵,如ABCB1、MDR1。MDR1的过度表达通常会导致对结构无关药物的交叉耐药性。在该研究中,我们观察到4例ABCB1过表达(27例中有15%可用于RNA测序)和1例DNA扩增未导致转录物上调。作者无法确定ABCB1上调是否是结构重排的结果。有趣的是,ABCB1上调的两个患者也有PARPi耐药的其他机制,这表明多种细胞途径并行作用,在PARPis治疗进展时导致临床耐药性。
该研究还显示,在后PARPi环境中,基因融合转录物的负担增加,这表明这些肿瘤的基因组不稳定性增强。这一初步观察值得在更大的数据集中进行进一步研究。在PARPis治疗后进展中观察到了CCNE1扩增,虽然这本身并不被认为是耐药机制,但由于与合成致死导致的BRCA1/2改变相互排斥,它通常被认为是对铂反应不良的替代生物标志物。然而,我们观察到BRCA1/2突变型肿瘤的CCNE1扩增比BRCA1/2野生型肿瘤多(分别为33%和15%),铂敏感型患者比铂耐药型患者多(分别为36%和20%)。与以前的报告相比,这些差异最可能的解释是EVOLVE研究中广泛的预处理和选择标准。仅在12%的档案(未经治疗)样本中检测到CCNE1扩增,可能是因为符合条件的患者以前对含铂化疗有反应,这是前线使用PARPi所必需条件。有趣的是,当检查基线样本时,BRCA1/2缺陷的患者缺乏随后的逆转突变,但也有CCNE1扩增,与所有其他患者相比,PFS有显著改善(中位数分别为7.6和2.5个月)。这表明这些患者至少具有这种合成致死表型的部分活性,尽管他们有很长的治疗史。对PARPis的耐药性也可以由SLFN11失活驱动,这可能会打开特定的治疗选择,如临床前模型中所建议的,对PARPis的耐药性是通过ATR抑制来克服的。
该研究的主要局限性之一是样本量小,但也是目前最大的前瞻性转化研究,具有成对的档案和基线活检样本,描述了PARPi后的耐药机制。这些结果值得在更大的前瞻性试验中进一步探索。这项研究的发现也可能受到肿瘤异质性的影响。PARPi后的活检部位是进行性病变,但这不一定是与档案组织相同的部位(PARPi前)组织。
总之,该研究表明西地尼布-奥拉帕利联合用药对PARPi失败后的卵巢癌患者有一定的疗效。同源重组基因逆转突变和/或ABCB1上调的患者,可能应该考虑其他选择。这项小型研究的观察值得进一步评估。已经观察到几个额外的PARPi耐药机制,可引导针对这些的潜在治疗机会。
参考文献:Lheureux S et al. EVOLVE: A Multicenter Open-Label Single-Arm Clinical and Translational Phase II Trial of Cediranib Plus Olaparib for Ovarian Cancer after PARP Inhibition Progression. Clin Cancer Res. 2020 Aug 15;26(16):4206-4215. doi: 10.1158/1078-0432.CCR-19-4121. Epub 2020 May 22. PMID: 32444417.

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
