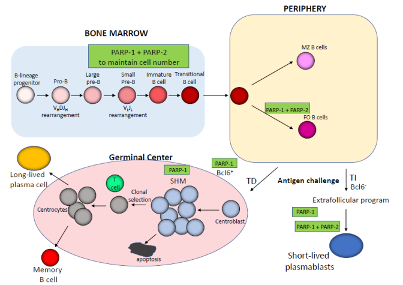
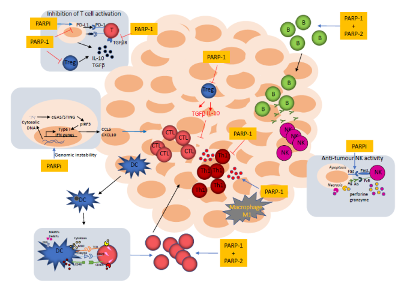
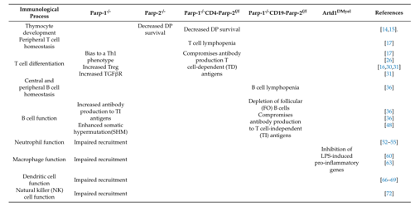
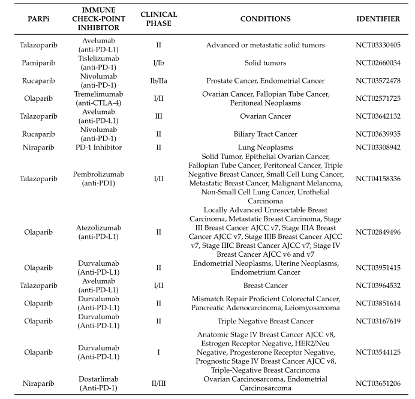
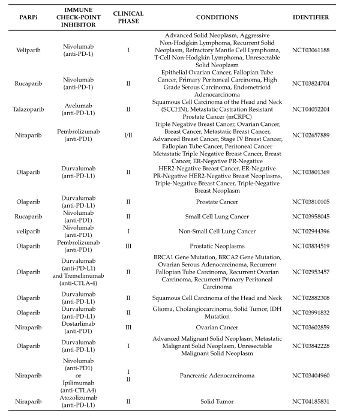
任婕 教授 医学博士,硕士研究生导师 贵州医科大学附属医院妇产科教授,医学博士,硕士研究生导师。 中华医学会肿瘤学分会妇科肿瘤学组全国委员 中华医学会妇科肿瘤学分会青年委员 贵州省医学会妇产科分会常委 贵州省医学会妇科肿瘤分会委员 近年在《Gynecologic Oncology》、《Journal of Medical Virology》、《International Journal of Gynecological Cancer》《中华妇产科杂志》发表论文10余篇,主持科研课题多项,是妇科临床药物试验主要研究者之一 2018年作为主要成员因“宫颈癌HPV感染、基因变异及敏感生物学标志物相关性的研究”获贵州医学科技奖三等奖 1.背景 在这篇综述中,我们重点介绍了PARP-1和PARP-2在免疫系统中的功能,以及它们可能的免疫调节作用如何影响肿瘤的反应。最近的数据表明,PARP-1和PARP-2在先天和适应性免疫反应中的特异性和冗余作用,以及PARP抑制剂的免疫潜力。了解PARP-1和PARP-2的免疫调节作用可能为合理开发和开发更具选择性的抗肿瘤PARP抑制剂药物提供宝贵的线索,无论是作为新的单药治疗还是与免疫治疗相结合。 2.PARP-1和PARP-2对T细胞发育和功能的影响 T细胞的发育是一个高度调控的过程,从骨髓来源的淋巴样前体开始,在胸腺中通过一个复杂的转录网络协调细胞的增殖、存活和分化,并通过具有良好特征的顺序成熟步骤形成成熟的T细胞 。虽然PARP-1和PARP-2蛋白在胸腺细胞中均有表达,但只有PARP-2在胸腺细胞发育中发挥重要作用。因此,parp -2缺乏而非parp -1缺乏的小鼠,DP胸腺细胞数量显著减少。这种表型与PARP-2在TCR细胞重组过程中防止DNA双链断裂(DSBs)的积累以及由此引发的DNA损伤诱导的凋亡反应的激活有关。相反,PARP-1调节tTreg的发育,而PARP-2似乎对tTreg的发育没有任何作用。一旦胸腺中的T细胞成熟,它们迁移到外周血淋巴组织,形成初始T细胞池,在那里它们继续分化形成完全免疫能力,对抗原产生适当的免疫T细胞反应。虽然PARP-1或PARP-2单独缺乏并不影响外周血淋巴组织的T细胞数量,但在T细胞室的双重缺乏将导致CD4+和CD8+外周血T细胞均显著减少。虽然PARP抑制剂不能像在PARP-1和PARP-2双基因缺陷的T淋巴细胞中那样实现持久的抑制,但这些抑制剂仍然可以影响T细胞间室,从而影响T细胞的免疫应答。细胞抗原被识别后,T细胞信号级联启动,导致NFAT1的激活和核易位,NFAT2, NFAT4,与其他转录因子如AP1相结合,调节细胞因子的表达和lineage-specific转录因子来控制通路的T细胞分化成Th1、Th2类型。值得注意的是,PARP-1在T细胞活化过程中被激活,在此过程中,PARP-1通过PARP化调节NFAT的活性,PARP抑制剂引起NFAT依赖的激活增加证明了这一点。(图1) 图1:T细胞发育的示意图描述了PARP-1和/或PARP-2在其中发挥作用的特定阶段。 TCR:T细胞受体;DN:双阴性;DP:双阳性;SP:单阳性;DC,树突细胞;Treg,调节性T细胞。 3.PARP-1和PARP-2对B细胞发育和功能的影响 与T淋巴细胞的发育一样,B细胞的发育发生在骨髓也是从多能造血干细胞开始的精确调控的过程。尽管PARP-1和PARP-2在DNA修复中的作用,但它们在Ig V(D)J基因重组中的作用仍不清楚或未知。最新数据显示,具有双重基因PARP-1和PARP-2缺陷的小鼠骨髓中的B细胞数量减少。与T细胞室一样,在PARP-1和PARP-2双重缺陷的小鼠中,B细胞淋巴细胞减少与增殖中的B细胞积累未修复的DNA损伤导致细胞死亡有关,这表明了一种潜在的模式,在淋巴增殖过程中,需要来自PARP-1和PARP-2的协调信号来维持基因组的完整性。离开骨髓的过渡性B细胞在外周淋巴器官中继续分化,从而形成成熟的边缘区(MZ)或成熟的滤泡(FO)B细胞。虽然单一的PARP-1或PARP-2缺乏不会影响外周淋巴组织中的B细胞室,但PARP-1和PARP-2的联合缺乏会损害外周B细胞的稳态。有趣的是,PARP-1和PARP-2的双重缺陷会损害对T细胞非依赖性抗原的抗体反应,但不会损害T细胞依赖性抗原的抗体反应。(图2) 图2:B细胞发育示意图,展示了PARP-1和/或PARP-2在其中发挥作用的特定阶段。 MZ:边缘区;FO:滤泡B细胞;TD:T细胞依赖抗原;TI:T细胞非依赖性抗原;SHM:体细胞超突变 4.PARP-1和PARP-2在天然免疫系统细胞成分中的作用 PARP-1和PARP-2除了在获得性免疫系统细胞成分的发育和功能中发挥作用外,还参与参与天然免疫反应的细胞的不同功能方面,包括中性粒细胞、巨噬细胞、树突状细胞和自然杀伤(NK)细胞。值得注意的是,PARP-1在中性粒细胞在与炎症相关的不同过程中的功能中起着重要作用。但是,PARP-2在中性粒细胞生物学中的作用仍然难以捉摸。PARP抑制剂抑制脂多糖诱导的促炎细胞因子,如肿瘤坏死因子α(肿瘤坏死因子α)、白细胞介素-1(IL-1)和IL-6由巨噬细胞表达。同时,最近的研究表明,PARP-1增强了LPS诱导的巨噬细胞促炎基因的转录活性。PARP-1和赖氨酸特异性的组蛋白去甲基化酶1A(LSD1)之间的功能相互作用可以保护促炎症的M1巨噬细胞在氧化条件下免于死亡。此外,在PARP-1缺陷的小鼠中,气道炎症模型中巨噬细胞的募集被严重阻断。但PARP-2在巨噬细胞中的作用仍不清楚。最近的研究表明,PARP-1在NK细胞生物学中具有重要作用。例如,PARP-1控制NK细胞募集到病毒感染部位。此外,PARP-1还参与了急性髓系白血病免疫逃逸中NK细胞激活受体配体的下调。(图3) 图3:PARP-1在先天免疫系统细胞中所起作用的示意图 5.PARP-1和PARP-2的免疫调节作用如何影响对肿瘤的免疫反应? 肿瘤不仅包含癌细胞,还包括其他类型的细胞,包括组织驻留和外周募集的免疫细胞、成纤维细胞和内皮细胞,它们构成了肿瘤的微环境。这些细胞之间的相互作用-癌症和非癌症-已知有利于或限制肿瘤的发生。T细胞,特别是CD8+细胞毒性T细胞(CTL)和CD4+Th1细胞,是肿瘤适应性宿主防御的主要贡献者。近来数据已经表明,来自PARP-1和PARP-2的协调信号是维持T细胞稳态和从幼稚T细胞分化为影响CD4+和CD8+谱系的效应性T细胞所必需的。双重PARP-1/PARP-2缺陷小鼠的T细胞淋巴细胞减少会影响淋巴细胞对肿瘤微环境的募集。此外,双重PARP1/PARP-2缺陷的T细胞分化为效应细胞的能力缺陷可能会对抗肿瘤反应产生影响。同样,双重PARP-1/PARP-2缺陷小鼠的B细胞淋巴细胞减少也会影响B细胞向肿瘤的募集。PARP-1在髓系细胞中的内在作用不依赖于它的酶活性,因此从药理学阻断的观点来看,其作用有限。 新兴的免疫治疗策略旨在通过调节T细胞共受体信号或通过使用单克隆抗体增强肿瘤相关抗原的识别来逆转免疫耐受。除了那些基于生物学方法的策略外,通过以细胞内信号通路为靶点的小分子方法(如使用PARP抑制剂)来改变免疫反应可能代表着一项突破,。这与免疫治疗是互补的,也可能是协同的。(图4) 图4:肿瘤微环境示意图,显示PARP-1或其与PARP-2或PARP抑制剂联合可能发挥作用的阶段。在方框中,已经纳入了关于PARP-1和/或PARP-2或PARPI在免疫反应参与的更多细节。CTL:细胞毒性T细胞;DC:树突状细胞;B:B细胞;PARPI:PARP抑制剂。 6.作为免疫调节剂的PARP抑制剂 PARP蛋白通过与配对蛋白的物理结合或通过配对蛋白的PARP化发挥其功能。虽然PARP蛋白的大部分免疫调节作用是基于对这些蛋白基因缺失的小鼠的研究,但PARP抑制剂可能会引起类似的免疫细胞改变,这将改变它们与肿瘤细胞的相互作用。最近的工作已经显示了PARP抑制剂可能如何影响肿瘤用于逃避免疫的机制,尽管这些研究中的许多都集中在肿瘤细胞的内在机制上,但这些研究可以为合理使用PARP抑制剂和其他旨在重新激活免疫系统对抗肿瘤的策略提供信息。(表1) 表1.PARP-1和/或PARP-2缺陷小鼠模型的免疫学表型 PARP抑制剂上调了癌细胞中PD-L1的表达,并增强了癌症相关的免疫抑制(图4)。通过阻断PD-1/PD-L1相互作用,这种免疫抑制是可逆的。Lassen, U的PD-1联合PARP抑制剂的研究确立了将PARP抑制剂与检查点抑制剂联合改变PD-L1表达的药物的理论基础,这引发了大量的临床试验开展(表2)。虽然Durvalumab和Oraparib联合治疗复发性小细胞肺癌患者的早期II期临床试验的结果没有达到预先设定的疗效标准,但我们等待正在进行的临床试验的结果,以更好地判断它们的有效性。此外,PARP抑制剂Niraparib已被证明可以增强I型干扰素信号和T细胞在肿瘤中的浸润,并改善抗PD-1的治疗效果。(表2) 表2.PARP抑制剂联合检查点抑制剂的临床试验 7.结论与未来展望 PARP抑制剂在癌症治疗中的前景最初是基于其对癌细胞本身基因组完整性的影响。从那时起,人们发现PARPS在细胞生物学的其他重要方面发挥着额外的作用,可能对肿瘤生理及其微环境都有重要意义。通过这篇综述,我们可以看到PARP-1和PARP-2的免疫调节作用是复杂的,具有特定和叠加的作用,其作用因细胞间隔和上下文而异。未来的工作将需要考虑PARP抑制对肿瘤微环境的影响,因肿瘤类型、分级和分期不同而不同。PARP抑制可作为免疫治疗策略的重要佐剂,或确实受益于检查点阻断本身,但需要进一步阐明其与免疫途径相互作用的确切机制。 参考文献:José Yélamos, Moreno-Lama L , Jimeno J , et al. Immunomodulatory roles of PARP-1 and PARP-2: Impact on PARP-centered cancer therapies[J]. Cancers, 2020, 12(2):392. 扫二维码 关注OC资讯 OC资讯小助手 为您提供更多帮助

 00:000:00 音频
00:000:00 音频