各位妇瘤同仁大家好,欢迎收听本期OC文献精读,我是今天的领读人,来自重庆医科大学附属第一医院的王辉医生,今天与大家分享的是2020年2月刊登在《JAMA》杂志的文章:HMG-CoA还原酶的基因替代抑制与上皮性卵巢癌的关系。

王辉 教授
重庆医科大学附属第一医院 妇科
主任医师、研究生导师
重庆市科技局项目评审专家;
教育部学位中心学位论文评审专家;
重庆市医师协会妇科肿瘤临床研究学组副组长。
从事临床医疗、教学科研工作20余年。熟练掌握妇科宫腹腔镜手术,擅长妇科良性疾病及恶性肿瘤的诊治。
承担临床医学妇产科中英文教学、全科医生及研究生教学。参与多项国家自科项目的研究;主持多项省部级科研教学课题的研究。在国内外重要学术刊物上发表科研及教学论文30余篇。

 00:000:00 音频
00:000:00 音频 1.背景
3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂(他汀类)是低密度脂蛋白(LDL)降胆固醇药物,通常用于预防和治疗心血管疾病。实验室研究表明,他汀类药物可以诱导细胞凋亡,抑制肿瘤的增殖、侵袭和转移。观察性研究报告使用他汀类药物的人与不使用他汀类药物的人相比,卵巢癌的发病率较低。但是,这些研究结果的临床相关性尚不清楚,因为临床前研究对人类的普适性未知。
2.方法
基因相关数据来自卵巢癌协会联盟(OCAC)对侵袭性上皮性卵巢癌的病例对照全基因组关联研究(GWAS)分析。分别获得了以下侵袭性上皮性卵巢癌组织类型的OCAC数据:高级别浆液性癌、低级别浆液性癌、子宫内膜样癌、粘液性卵巢癌和透明细胞癌。在OCAC研究中,患者最早的入组时间是1976年,最晚的随访日期至2015年。回顾性队列研究BRCA1/2修饰物研究者联合会(CIMBA)对BRCA1(Entrez基因:672)或BRCA2(Entrez基因:675)突变携带者中的上皮性卵巢癌的GWAS分析也获得了概要数据。为了生成基因工具来替代HMG-CoA还原酶、NPC1L1和PCSK9,并直接替代LDL胆固醇水平,从GWAS对全球脂质遗传学联合会中LDL胆固醇水平的荟萃分析中获得了概要数据。采用孟德尔随机化分析假设用于替代风险因素的遗传工具。主要分析是在普通人群(OCAC)和BRCA1/2突变携带者(CIMBA)中,基因代理的HMG-CoA还原酶抑制与总体和组织特异性侵袭性卵巢癌的相关性。次要分析是基因抑制NPC1L1和PCSK9和基因替代循环低密度脂蛋白胆固醇与这些卵巢癌预后的关系。主要分析和次要分析是预设的。(图1)显示了HMG-CoA还原酶基因替代抑制与上皮性卵巢癌相关性研究的遗传学工具构建、数据来源和分析方案的示意图。对于每个药物靶标或危险因子,通过获得与位于药物靶标编码基因3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶、NPC1L1、 PCSK9内或附近的低密度脂蛋白(LDL)胆固醇相关的单核苷酸多态性(SNPs)的概要遗传关联数据来构建遗传工具。然后从侵袭性上皮性卵巢癌(OCAC)和BRCA1/2突变携带者上皮性卵巢癌(BRCA1/2修饰物研究者联合会)的全基因组关联研究中提取这些SNPs的遗传相关数据。再通过分配相同的效应等位基因来匹配数据集上的SNPs之后,孟德尔随机化分析使用逆方差加权随机效应模型作为主要分析。最下面的框显示了相应的药物靶标及危险因素的统计学分析,代表使用不同的敏感性分析来测试药物靶标分析和LDL胆固醇的孟德尔随机化假设。
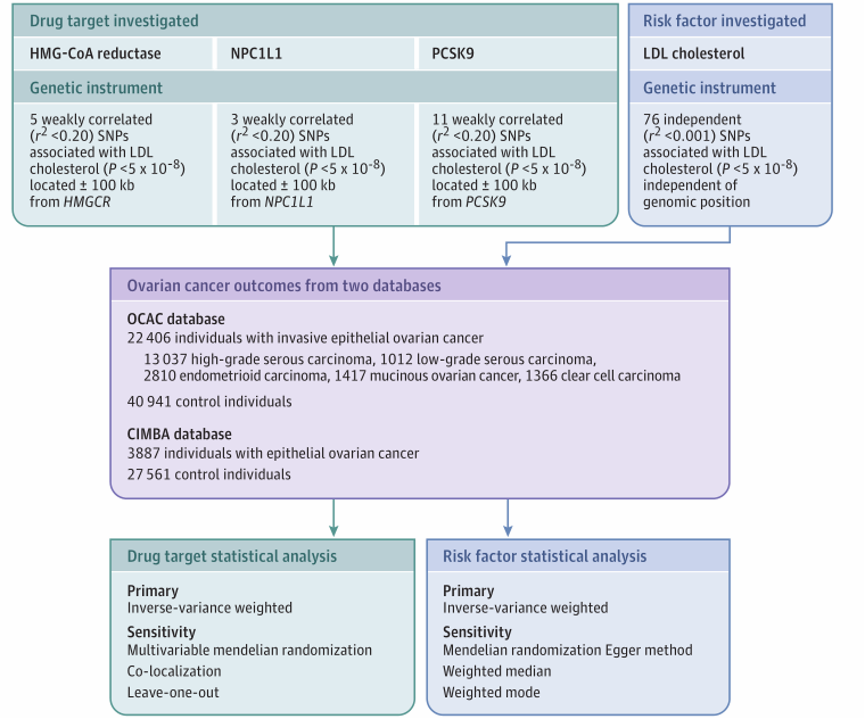
图1:HMG-CoA还原酶基因替代抑制与上皮性卵巢癌相关性研究的遗传学工具构建、数据来源和分析方案的示意图。
3.结果
在1936名参与者因缺少基因型而被排除后,OCAC的分析样本包括侵袭性上皮性卵巢癌22,406名女性,与40941名欧洲血统人种对照。参与者来自14个国家(美国、澳大利亚、白俄罗斯、德国、比利时、丹麦、芬兰、挪威、加拿大、波兰、英国、西班牙、荷兰和瑞典)。CIMBA样本包括3887名患有上皮性卵巢癌的女性和27561名欧洲血统的对照个体。CIMBA的参与者来自25个国家(包括20个欧洲国家、美国、澳大利亚、加拿大、以色列和南非)。全球脂质遗传学联合会样本包括少于或等于196475人,他们主要是欧洲血统(96%的人)。
用于替代药理靶点的HMGCR、NPC1L1和PCSK9中的遗传变异的特征如(表1)所示。总之,利用HMGCR中的5个SNP(rs12916、rs10515198、rs12173076、rs3857388、rs7711235)替代HMGCoA还原酶抑制,NPC1L1中的3个SNP(rs2073547、rs217386、rs7791240)替代NPC1L1抑制,PCSK9中的11个SNP(rs11591147、rs11206510、rs2479409、rs585131、rs11206514、rs2495477、rs572512、rs2479394、rs12067569、rs10493176、rs11583974)中代替PCSK9抑制。用来替代药物靶点的SNP的有效等位基因频率在GWASs中测量的LDL胆固醇水平、普通人群中的侵袭性上皮性卵巢癌(OCAC)和BRCA1/2突变携带者中的上皮性卵巢癌(CIMBA)中相似。
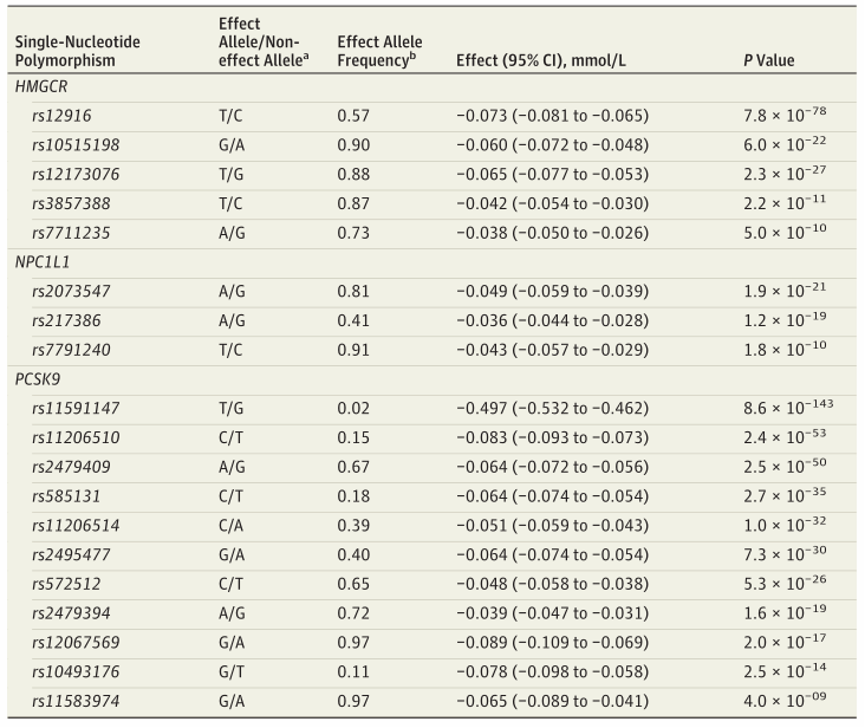
表1:HMGCR、NPC1L1和PCSK9的降低密度脂蛋白基因变异特征
主要分析
基因替代的HMG-CoA还原酶抑制相当于LDL胆固醇降低1 mmol/L(38.7 mg/dL),与OCAC中的侵袭性上皮性卵巢癌显著相关(OR,0.60[95%CI,0.43-0.83];P=0.002;表2和图2)。这种相关性在评估的5种侵袭性组织类型中没有显著差异(异质性的P值=0.84;I2=0.00%)。在CIMBA联合BRCA1和BRCA2突变携带者之间的分析中,基因替代的HMG-CoA还原酶抑制与上皮性卵巢癌的风险显著相关(HR,0.69[95%CI,0.51-0.93];P=0.01;图3)。
次要分析
在卵巢癌协会联盟(OCAC)样本中,基因替代抑制NPC1L1(OR,0.97[95%CI,0.53-1.75];P=0.91)和PCSK9(OR,0.98[95%CI,0.85-1.13];P=0.80)与总体或组织类型分层的卵巢癌无显著相关性(表2和图2)。虽然基因替代的循环低密度脂蛋白胆固醇与总体卵巢癌没有明显的相关性(每1 mmol/L的低密度脂蛋白降低:OR,0.98[95%CI,0.91-1.05];P=0.55),但在组织类型分层分析中,基因替代的循环低密度脂蛋白胆固醇降低1 mmol/L与侵袭性粘液性卵巢癌显著相关(OR,0.80[95%CI,0.65-0.98];P=0.03)。在检测水平多效性的敏感性分析中,基因替代的低密度脂蛋白胆固醇与总体和组织类型特异性卵巢癌的相关性的研究结果在很大程度上是一致的(附录表4)。在CIMBA的BRCA1/2突变携带者之间的分析中,NPC1L1(HR,0.95[95%CI,0.56-1.61];P=0.84)、PCSK9(HR,0.92[95%CI,0.78-1.08];P=0.31)或遗传代理的循环LDL胆固醇水平(HR,0.96[95%CI,0.90-1.03];P=0.24)与上皮性卵巢癌HR没有显著的相关性。
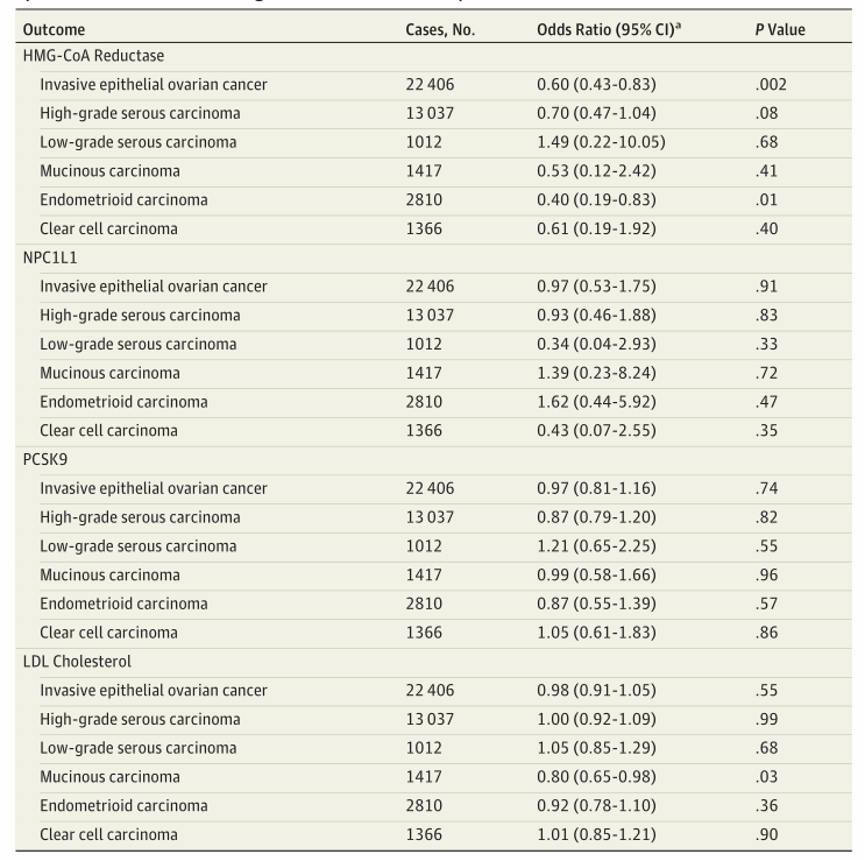
表2:基因替代抑制HMG-CoA还原酶,NPC1L1和PCSK9与基因替代的低密度脂蛋白(LDL)胆固醇水平与总体和组织类型特异性侵袭性上皮性卵巢的关系
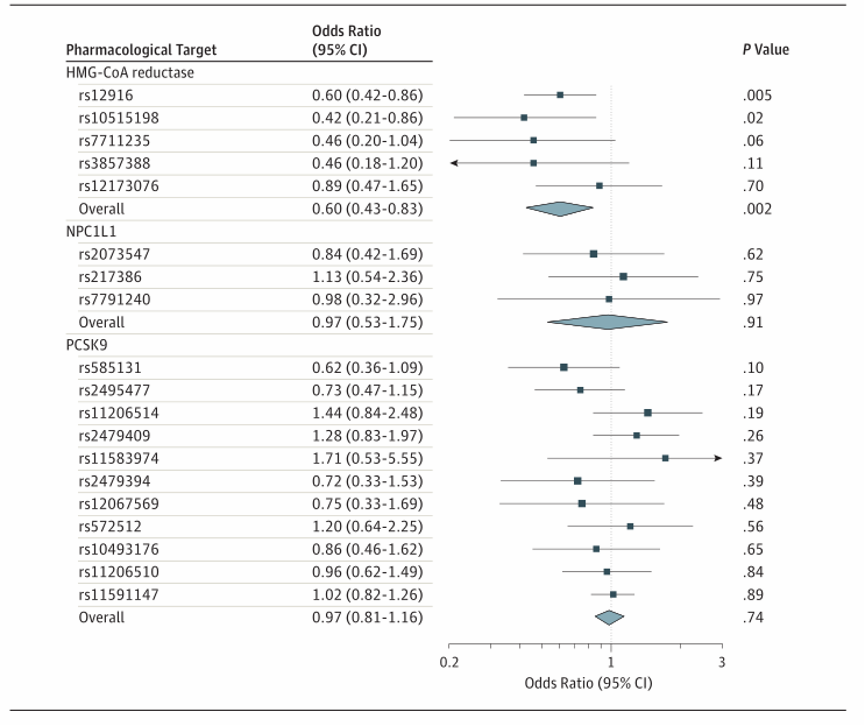
图2:孟德尔随机化评估3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶、NPC1L1和PCSK9与普通人群女性侵袭性上皮性卵巢癌的关系
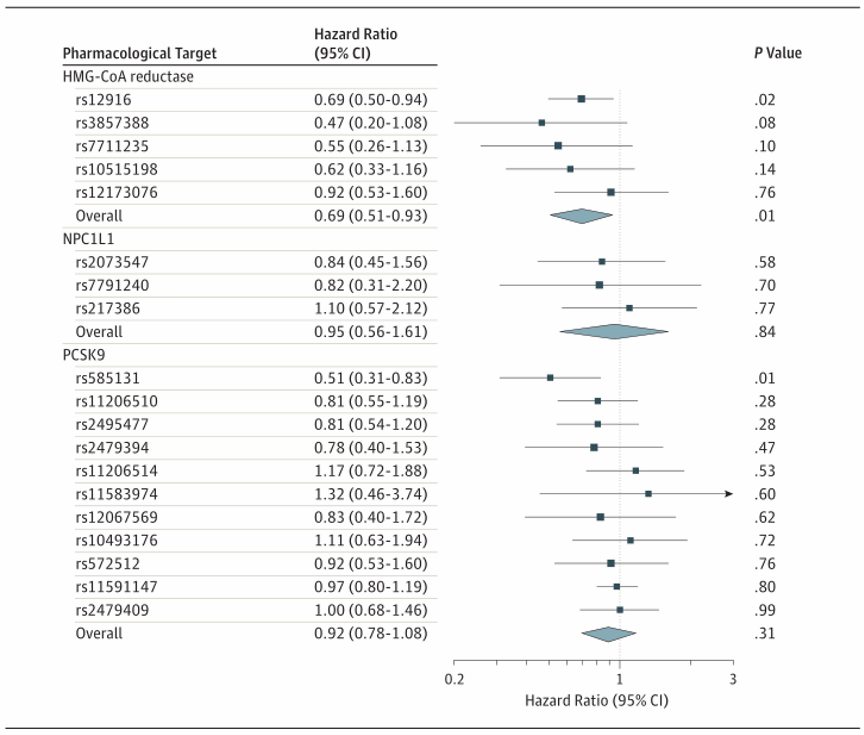
图3:孟德尔随机化估计上皮性卵巢癌BRCA1/2突变携带者与HMG-CoA、NPC1L1和PCSK9相关性
附录表4:在检测多效性的敏感性分析中,基因替代的LDL胆固醇水平与OCAC中侵袭性上皮性卵巢癌总体风险和组织特异性之间的关系
敏感性分析
在应用Bonferroni校正来解释OCAC所有侵袭性上皮性卵巢癌分析中的多重检测的敏感性分析中(P<0.01),基因抑制的HMG-CoA还原酶抑制与侵袭性上皮性卵巢癌的风险仍然显著相关(P=0.002)。
4.讨论
在这项孟德尔随机分析中,对22406名侵袭性上皮性卵巢癌妇女和40941名对照组进行了分析,基因替代抑制HMG-CoA还原酶与上皮性卵巢癌发病几率降低显著相关。当分析限于BRCA1/2突变携带者时,也观察到类似的相关性。在普通人群或BRCA1/2突变携带者中,基因替代的NPC1L1或PCSK9抑制或LDL胆固醇水平与上皮性卵巢癌没有显著相关,支持HMG-CoA还原酶抑制可能的机制特异性效应。HMG-CoA还原酶抑制和上皮性卵巢癌的研究结果与实验室和大多数流行病学研究的结果一致。他汀类药物已被证明在卵巢癌的细胞系和动物模型中具有抗增殖和抗侵袭的特性。胆固醇生物合成途径中的HMG-CoA还原酶抑制甲羟戊酸的合成对该途径中的各种下游产物有影响,包括类固醇前体的水平,其中一些与卵巢癌的风险有关。比如新英格兰病例对照研究(2040名上皮性卵巢癌患者和2100名对照人员)的分析显示,与不使用他汀类药物的女性相比,自我报告使用他汀类药物的女性患卵巢癌的几率显著降低(OR,0.68[95%CI,0.54-0.85])。本研究的优势在于使用简要的遗传关联数据,使得可以从几个大型GWAS对脂质和卵巢癌的荟萃分析中对SNP暴露和SNP结果关联进行相对精确的估计,从而提高分析的统计能力和精确度。对于未来展望,将这项研究中提出的分析扩展到被诊断为卵巢癌的妇女中,可以了解他汀类药物对卵巢癌进展和生存的潜在治疗效果。在高危人群(BRCA1/2突变携带者和/或多基因高危妇女)中进行随机临床试验设计将是必要的,以提供他汀类药物在这些人群中预防卵巢癌中作用的证据。
当然这项研究也有一定局限性。首先,药物靶标的直接测量方法无法产生这些靶标的每单位功能变化所降低的卵巢癌风险的估计值。其次统计能力仅限于检测与不常见的侵袭性组织类型(低级别浆液性癌、粘液性癌和透明细胞癌)的相关性。所提出的分析假设药物靶标的遗传代理与卵巢癌(例如,基因-环境、基因-基因)之间没有交互作用,药物靶标抑制与癌症风险之间没有线性关联。如果他汀类药物治疗可以降低卵巢癌的风险,那么服用他汀类药物降低风险的程度可能与本分析中观察到的效应大小不符等。
5.总结
基因替代抑制HMG-CoA还原酶与上皮性卵巢癌发病几率降低显著相关。然而,这些发现并不表明抑制HMG-CoA还原酶的药物降低了风险;还需要进一步的研究来了解此类药物是否存在类似的效应。
以上是我今天分享给大家的全部内容,感谢聆听。OC文献精读每周二与您相约,下周二再会!
参考文献:James Yarmolinsky, Caroline J. Bull, Emma E. Vincent, et al. Association Between Genetically Proxied Inhibition of HMG-CoA Reductase and Epithelial Ovarian Cancer [J]. JAMA,2020;323(7):646-655.

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
