本期OC文献精读邀请到中山大学孙逸仙纪念医院妇科肿瘤的张丙忠教授,跟大家一起分享2020年三月份发表在NATURE COMMUNICATIONS杂志(IF:11.878)上的一篇题为关于探讨PARP抑制剂联合PD-1抑制剂治疗的卵巢癌患者相关免疫基因组分析的文章。虽然已经有多项研究显示PARP和免疫检查点抑制剂联合应用在卵巢癌中能够起到协同抑制肿瘤的作用,但目前仍缺乏有效的预测性的生物标志物。
本期OC文献精读邀请到的领读人是武汉大学人民医院的李新医生。本期文章是《The forefront of ovarian cancer therapy: update on PARP inhibitors》,该文章于2020年6月被《Annals of Oncology》接收,其通讯作者是著名的NOVA研究 Leading PI Prof. Mansoor Raza Mirza。M.R.Mirza是丹麦哥本哈根大学医学院首席肿瘤学家;北欧妇科肿瘤研究组织(NSGO)的 医学总监;妇科肿瘤国际工作组(GCIG)的执行董事;同时担任欧洲肿瘤内科学会 (ESMO)和国际妇科肿瘤学会(IGCS) 欧洲妇科肿瘤研究组织 (ESGO)的教员。

李新 教授
副主任医师
医学博士
武汉大学人民医院副教授
中国医疗保健国际交流促进会生殖与微创学组委员
湖北省抗癌协会妇科肿瘤专业委员会青委副主任委员
中国中药协会女性生殖健康药物研究专业委员会委员
湖北省妇科疾病防治专业委员会委员

 00:000:00 音频
00:000:00 音频 作者认为近5年的研究证实PARP抑制剂已然改变铂敏感卵巢癌的治疗模式。近2年的研究数据支持早期应用PARP抑制剂。也发现了卵巢癌一线治疗结果的很多影响因素,其中一个关注的热点就是对于复发性卵巢癌患者,铂的敏感性是能否选择PARP抑制剂治疗的最可靠的诊疗指标;但是在治疗初期,无法获悉该患者是否为铂敏感患者,更多的需要依赖BRCA和HRD检测,而现有的HRD检测方法还亟待改进。相比较而言,尼拉帕利被FDA批准为铂敏感复发卵巢癌患者的维持治疗,而无需考虑HRD的状况,为所有患者提供了一种选择,从一定程度上减少了对HRD检测的依赖。
作者通过回顾分析四个同在一线的临床试验(分别是SOLO-1, PAOLA-1/ENGOT-OV25, PRIMA/ENGOT-OV26 和 VELIA/GOG-3005的)的关键点,为临床医生提供更为客观的视角,去评估对新诊断的卵巢癌患者PARP抑制剂在不同的生物标志选择人群的有效性和安全性,通过对这些实验设计、疗效、安全性等方面的分析,探索在未来的研究中,针对部分PARP抑制剂疗效不理想的病人,如何重点探索新的治疗方案,同时更为我们的临床维持用药做出了指导。
首先,回顾这4个研究的实验设计:这四个实验在设计上有很大的不同,特别是在对照组的设置、研究人群、PARP抑制剂治疗的起始时间和持续时间差别很大,这些不同的实验设计反映了临床发展的多样性和目标人群的差异性。同时每个实验也都有各自的局限性。(见表一)
SOLO-1所研究的对象是BRCA突变的患者,82%的患者没有疾病证据,CA125都是正常水平,贝伐珠单抗不被允许使用。
PRIMA研究入组的人群,67%都接受过NACT,但贝伐组的缺失也是其局限性。
POLO-1/ENGOT-O25奥拉帕利单臂研究的缺失是它的局限性。
VELIA/GOG-3005是从经典治疗模式开始贯穿到维持治疗为止,PFS的结点也不同,试验设计与GOG-0218试验非常相似,对GOG-0218的一些批评也可能在VELIA/GOG-3005中也存在,Veliparib在伴随化疗阶段的贡献很难被定义,而且存在贝伐珠单抗组研究缺失的局限性。


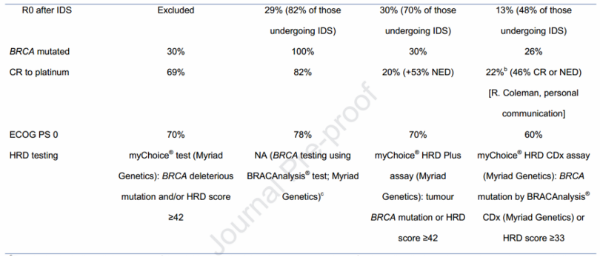
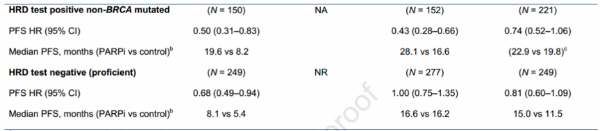
其次,从疗效来分析:总的来讲,每一个研究都有力的证明了PARP抑制剂在卵巢癌一线治疗中的作用,大部分次要终点数据也支持主要终点的结论。但所有的OS数据都不成熟,所有的研究主要终点都是PFS。在SOLO-1中,只有BRCA突变的人群纳入研究,非BRCA突变患者被排除在外。在PAOLA-1/ENGOT-OV25研究中,预期奥拉帕利联合贝伐珠单抗在non-BRCA-mutationgs肿瘤人群中将会获益,然而实验显示对比贝伐组并没有更好。在PRIMA/ENGOT-OV26研究中,主要的分析人群是HRD+或HRD-/HRD状态不明的人群,后又分析了all-comer人群。在SOLO-1和VELIA/GOG-3005研究中,SOLO-1中的主要终点和VELIA/GOG-3005分层研究中的第一个群体也是BRCA突变的患者。另外因为这些研究开始的时间都是不同的,因此PFS计算方式不尽相同,单纯就这些数据比较是没有意义的。(表二)

接下来是安全性方面:在这四个研究中,PARP抑制剂治疗组因为副反应而中断治疗的比例确实比对照组高,最高的是PAOLA-1/ENGOT-OV25。在解读这个结果的时候我们要关注治疗时间的长短。在PRIMA/ENGOT-OV26研究中发现尼拉帕利主要的副作用是贫血和血小板减少。值得注意的是,针对体重小于77公斤、血小板计数小于150 000/mm3的患者采用个体化治疗,剂量从300毫克减少到200毫克,尼拉帕利副作用显著的减少。(表三)


在治疗策略方面的启示:虽然这四个研究一致支持PARP抑制剂在卵巢癌一线维持治疗中的应用,但是由于实验设计,研究对象的不同和结果的差异,所以在做治疗决策的时候还是要思考几个问题:
对于BRCA突变的患者毫无疑问选择PARP抑制剂治疗,但是否需要联合使用贝伐珠单抗?
HRD阳性但是没有发生BRCA突变的患者是否需要联合使用贝伐珠单抗?
考虑到没有发生BRCA突变、HDR阴性的患者,PARP抑制剂疗效差,是否需要先用贝伐珠单抗,还是等复发以后再用PARP抑制剂?
如果这样合理,对复发性卵巢癌患者,单独使用PARP抑制剂对生存率会有什么样的影响?
针对这一部分没有发生BRCA突变、HDR阴性的患者该如何选择治疗方案也是一个很大的考验。
我们对药物的选择一方面需要考虑药物的临床试验数据,是否需要联合贝伐珠单抗以及药物获取渠道,费用报销等问题,另一方面还要考虑到后续的治疗问题,比如手术方式与BRCA的关系。
因为实验设计和研究对象的不同,不能直接去比较这四个不同研究的数据,需要综合考量多方面因素。(见表四)


研究中还有重要的部分是HRD检测:在HRD检测方面,这四个研究采用了两个不同的HRD检测方式,有三个研究(PRIMA/ENGOT-OV26,PAOLA-1/ENGOT-OV25和VELIA/GOG-3005)采用的是Mychoic公司的检测方式,其中PRIMA和PAOLA-1采用的是相同的cut-off值≥42来定义HRD阳性的,而在VELIA/GOG-3005研究采用的是cut-off值≥33来定义HRD阳性的,SOLO-1则是采用了FoundationFocus公司的检测方式,这就造成同称为HRDmutation或者HRDwt,但其实他们真正的生物标志物是不一样的,那么这就对研究结果必然也会产生影响。另外,HRD检测并没有成为常规检测手段,因为部分标本无法准确的检测出HRD状态、结果有假阴性、费用高以及频繁使用NACT等局限性,很多团队在研究新的HRD检测方法,包括鉴定HR基因的染色体突变、基因组突变、新一代的基因测序和HRD基因转录与功能分析等方法。但这些新的方法都需要大量的样本研究确认其有效性。
最后作者基于这四个研究,梳理了未来研究的重点:这四个研究显然无法回答临床上的所有问题,未来还需要更多的临床研究去做出答案,并给我们更多的临床思路。对HRD阴性的肿瘤患者进行更好的识别和治疗,将PARP抑制剂与其他的药物联合使用,为这些患者探索更有效的治疗方法是未来研究的重点。在抗血管生成治疗的基础上,免疫治疗药物可能对这些高需求的患者更为重要。一方面我们要研究如何开发新的药物或者是组合现有的药物,另一方面我们要思考肿瘤复发以后该如何治疗。目前已经有一些临床研究正在进行中,我们拭目以待。此外,PARP抑制剂与作用于DDR信号通路的药物联合使用,从理论上讲也是可行的。
总之,随着PARP抑制剂的引入,卵巢癌的治疗格局发生了巨大的变化。影响卵巢癌患者一线治疗的因素包括临床危险因素、分期、手术时机、临床条件、并发病、贝伐单抗的使用、BRCA检测结果以及药品报销政策。对于复发性卵巢癌患者如何选择PARP抑制剂需要依赖还在改进中的基因检测技术。尼拉帕利被FDA批准为铂敏感复发卵巢癌患者的维持治疗,不需要考虑HRD的状况,很大程度上地解决了这一难题,减少了对HRD检测的依赖。

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
