本期OC文献精读邀请到中山大学孙逸仙纪念医院妇科肿瘤的张丙忠教授,跟大家一起分享2020年三月份发表在NATURE COMMUNICATIONS杂志(IF:11.878)上的一篇题为关于探讨PARP抑制剂联合PD-1抑制剂治疗的卵巢癌患者相关免疫基因组分析的文章。虽然已经有多项研究显示PARP和免疫检查点抑制剂联合应用在卵巢癌中能够起到协同抑制肿瘤的作用,但目前仍缺乏有效的预测性的生物标志物。
本文从免疫基因组的角度对TOPACIO研究中联合使用尼拉帕利和派姆单抗用药的患者进行分析,发现两个决定药物响应的标志,并运用单细胞成像分析药物响应机制,确立个体样本内单细胞空间特征等。

张丙忠 教授
主任医师
医学博士、硕士研究生导师
中山大学孙逸仙纪念医院妇科肿瘤专科副主任,硕士研究生导师
广东省医师协会妇科肿瘤分会秘书、委员
广东省医学会妇科肿瘤学组委员
广东省精准医学会妇科肿瘤分会委员
广东省妇科微创学会常务委员

 00:000:00 音频
00:000:00 音频 1.样本(这项研究的样本来自于TOPACIO研究)
TOPACIO研究是一项评估尼拉帕利联合派姆单抗用于晚期三阴性乳腺癌或复发性卵巢癌的I/II期临床试验。研究入组了62例既往接受过一线含铂方案化疗且疗效持续时间≥6个月的晚期卵巢癌患者,研究者评估患者为PROC(即不再适合接受铂类治疗),即排除了原发性铂类耐药但未排除继发性耐药的患者。最终这些患者平均治疗线数为3线,其中76%的患者有获得性铂耐药或铂难治,其余24%患者由于毒性或过敏反应而无法接受铂治疗。研究经过I期阶段确定给药剂量:尼拉帕利200 mg/d,口服+ 派姆单抗200 mg,静脉注射,q21d。研究样本均来自于这62名患者,其中30个样本在诊断时获得,即未接受化疗的样本,32个样本接受铂类化疗后获得。TOPACIO 研究最终证实了尼拉帕利+派姆单抗联合方案不仅耐受性良好,且疗效可靠,ORR为25%,DCR为65%,明显超过了尼拉帕利或派姆单抗作为单一疗法治疗复发性耐铂卵巢癌的预期活性,响应持久的,且中位PFS尚未达到。
尽管联合治疗效果良好,但仍有许多患者没有应答,这表明迫切需要预测性生物标志物来前瞻性地鉴别哪些患者能够从PARP抑制剂+PD-1抑制剂联合治疗中获益,而目前已知的BRCA突变检测、同源重组缺陷检测和PD-L1评分无法达到预测效果。本研究中不仅对样本进行了BRCA突变(tBRCAmut)检测和 HRD(同源重组修复缺陷)检测(Myriad Genetics),同时也采用BROCA检测、免疫组化(IHC)、 OncoPanel测序及多元特征计算工具SigMA(Signature Multivariate Analysis)等多种手段来进行探索。
SigMA,是一个能够从低突变counts中精确的发现与HRD相关的突变特征的工具。研究对来自于35个肿瘤纯度>20%的样本所测出447个癌相关基因的突变和拷贝数变异进行SigMA分析,识别与HRD相关的突变特征,并将其命名为突变特征3,Sig3。最终确定51%(20/39)的患者中存在Sig3阳性,且与临床获益密切相关。
为了解免疫微环境,研究对于所有样本进行了NanoString基因表达分析,生成通路类型和细胞类型的评分。在未化疗的样本中,若在三种干扰素通路中的任何一个score≥25%,认为这些样本是免疫评分(IS)阳性的,其余为阴性;在化疗后样本中,若CD8 + Tcell/CD8T-cell score≥25%,认为这些样本是IS阳性的,其余为阴性。综合评分使用Sig3和IS,若样本Sig3或IS为阳性,那么该肿瘤的综合评分判定为阳性;若Sig3且IS都为阴性,则该样本的综合评分为阴性。从结果看,IS和Sig3可以识别所有客观应答患者。
单细胞成像数据分析是使用flowSOM对细胞计算细胞型标签。对数据使用半监督的UMAP降维来实现可视化。通过与1000次的随机扰动比较,使用fold-change 定义细胞互相作用出现的显著性,将细胞互作划分为“吸引”和“躲避”。
2.结果解读
1.与临床获益相关的突变特征3(Sig3)
为了识别与临床获益相关的特征,使用不同的评估方法将样本划分为HRD阳性和阴性。发现SigMA方法能够识别最大比例的HRD阳性(图1a),Fisher’s检验发现,只有SigMA方法分类的样本与药物响应相关(图1b),Sig3阳性患者中SD或PR(p= 0.02,Fisher精确检验)的比例多于PD。图1c展示根据Sig3分类的样本在疾病进展(PD)、疾病稳定(SD)和部分响应(PR)的患者中分布情况。Sig3阳性患者联合治疗有较好的无复发生存期,中位PFS为5.0个月[2.1–22.7]而Sig3阴性的患者为2.2个月[0.5–8.6],HR 0.37(95%CI 0.17–0.80)(图1d)
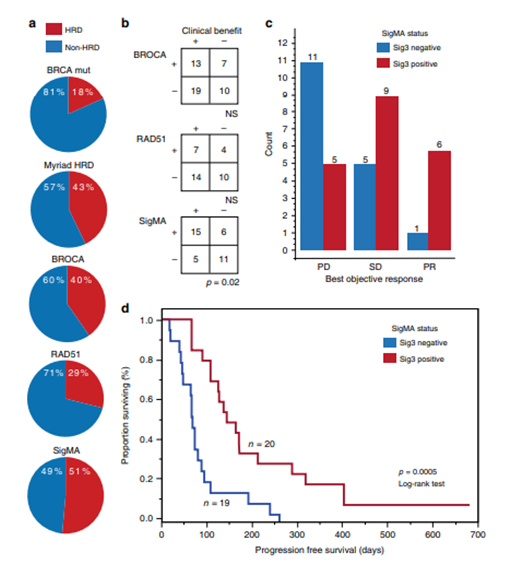
图1.突变特征3与延长无进展生存期相关
2.免疫评分(IS)和 Sig3能识别所有的客观响应患者
经NanoString基因表达分析发现化疗前和化疗后的样本免疫环境中基因表达模式有显著不同,化疗后样本免疫相关通路和免疫细胞score分数较高,这些样本与免疫组化检测的PD-L1正相关。可以发现,化疗前后的样本在多方面有差异,所以下面的分析将两类样本分别分析。在无化疗样本中,使用Mann-Whitney U检验研究药物响应与非响应患者的通路差异,发现响应的样本有六个通路显著富集(图2a),在这些通路中,有3个与Type-I干扰素信号通路相关,这些通路也与客观响应率显著相关(图2b)。
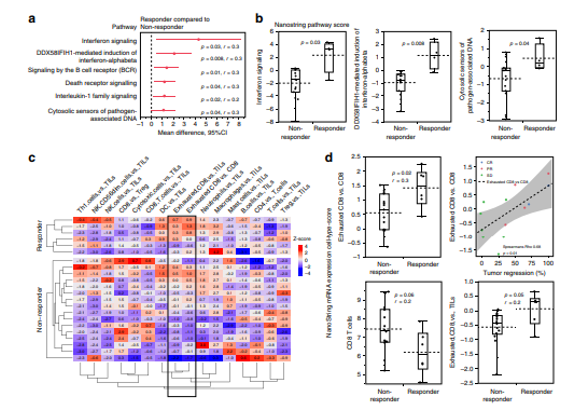
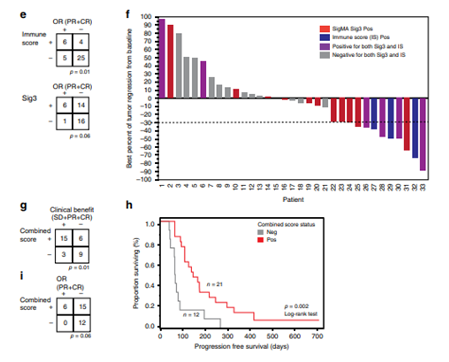
图2.免疫特征与肿瘤进展和客观响应相关
在化疗后样本中,观察到相对的耗竭CD8 + T-cells在响应组的细胞类型评分高于非响应组(图2c)。
Fisher’s检验发现,IS(免疫打分)与OR显著正相关(图2e),图2f的瀑布图所示,所有肿瘤衰退的患者(限定衰退比例≥30%)中,Sig3或IS或两者都呈阳性。综合评分与临床获益相关(图2g),与延长PFS相关(图2h)。综合评分为阴性的患者无客观响应(图2i)。
3. 单细胞成像反应药物响应机制
对26个肿瘤进行高度多重化单细胞成像,可以识别免疫细胞类型和测定功能细胞状态。接受化疗导致肿瘤细胞比例降低,免疫细胞和基质细胞的比例比未接受化疗的样本更高(图3c)。
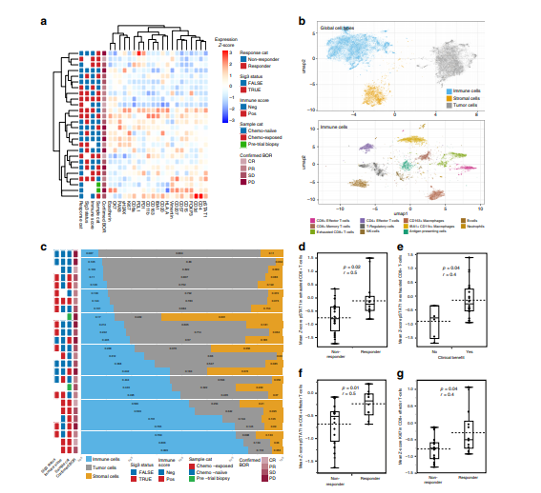
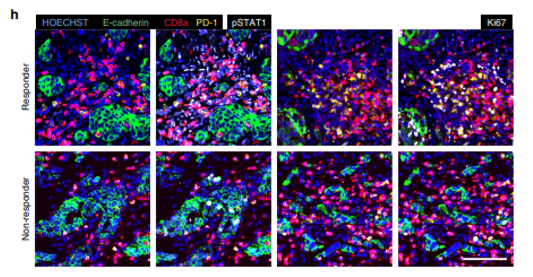
图3.干扰素激活和CD8 + T-cells增殖状态与药物响应相关
4.超反应案例独特的单细胞空间特征
研究中也对两个超反应患者的样本进行了更深入的表型分析,这两位患者都是铂类耐药,用药后经历了长期的部分响应阶段。第一个病人的PR持续了10个月,从基线开始有87%的肿瘤消退(图4a),她的肿瘤中Sig3呈阳性,BROCA分析显示BRCA1的高甲基化和TP53功能缺失的突变,肿瘤中CD163 + IBA1 + CD11b +巨噬细胞和耗竭 CD8 + T-cells 富集(图4b),且PD-L1高表达(图4c,d)。对样本中细胞类型进行空间聚类,耗竭CD8 + T cells的邻居包括PD-L1 +巨噬细胞和树突状细胞(图4e,f)。这个现象说明巨噬细胞或树突状细胞与耗竭CD8 + T cells之间的相互作用可能是该样本PD-1/PD-L1介导的免疫抑制中最相关的细胞-细胞相互作用。
第二个超反应者达到PR且持续响应时间超过一年,有53%的肿瘤消退。样本是Sig3阳性,有PD-L1和PD-L2扩增(图4g)。邻近分析显示有CD8 + Tcells和PD-L1阳性的肿瘤细胞的聚集,而PD-L1阳性的巨噬细胞则单独聚集(图4h)。此外,耗竭CD8 + t细胞在空间上与PDL1+肿瘤细胞聚集在一起,而邻近的PD-L1-阳性巨噬细胞在空间上单独聚集(图4i)。该样本有丰富的免疫抑制PD-L1/PD-1信号,特别是在PD-L1-阳性的癌细胞中。
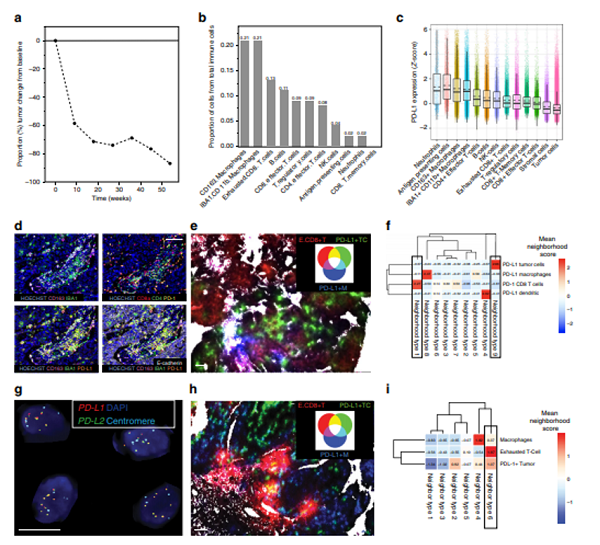
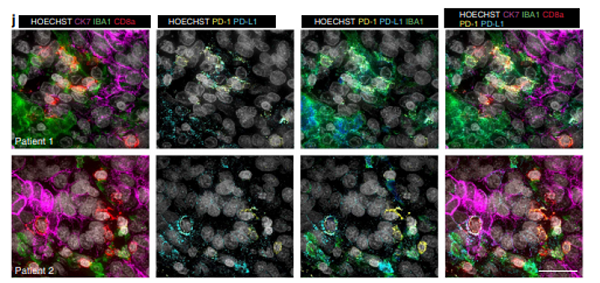
图4.两例极端反应的肿瘤在肿瘤微环境中表现出不同的细胞相互作用的空间模式
5. Exhausted CD8 + T-cell互作与响应相关
接下来对26个样本的t-CyCIF数据进行统计邻域分析,以确定肿瘤微环境中细胞亚群的空间相互作用是否与响应相关。实验观察到Exhausted CD8 + T-cells与巨噬细胞的相互吸引与药物响应显著相关(图5b)。还发现相对于非响应者,应答患者有高比例的PD-L1-positive巨噬细胞(图5c)和肿瘤细胞(图5d)邻近 exhausted CD8 + T-cell。

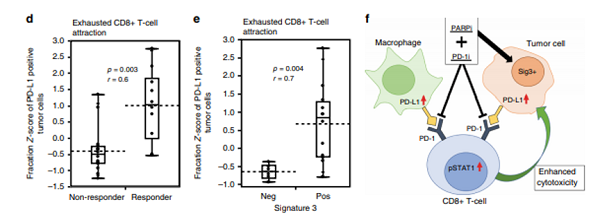
图5.exhausted CD8 + T-cells的空间相互作用与响应和突变特征3相关
3.总结
本研究对使用尼拉帕利和派姆单抗用药的患者进行分析,发现决定药物响应的标志,突变特征3,免疫打分,及干扰素激均于OR和临床反应相关。这将有助于我们在临床中选择可能获益于PAPR抑制剂联合免疫治疗的患者。

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
