
邹冬玲 教授
副主任医师
医学博士、硕士生导师
重庆市肿瘤医院/重庆大学附属肿瘤医院
美国希望之城国家医疗中心访问学者
美国辛辛那提大学癌症研究所访问学者
中国抗癌协会妇科肿瘤专委会常务委员
中国抗癌协会青年理事会常务理事兼轮值秘书长
中国医促会妇产科分会青年委员会常务副主委
中华医学会肿瘤分会青年委员
中国临床肿瘤学会患者教育专家委员会委员
中国妇幼保健协会妇科肿瘤防治专业委员会委员
北京医学奖励基金会妇科肿瘤专家委员会副主任委员
中国青年科技者协会会员
重庆市医师协会肿瘤医师分会妇科肿瘤临床研究学组(CQGOG)组长
重庆市卫计委医学高端后备人才

 00:000:00 音频
00:000:00 音频 1.背景
新诊断卵巢癌的治疗通常包括肿瘤细胞减灭术和铂-紫杉醇联合化疗。抗血管生成联合化疗方案是卵巢癌全身治疗的重要进展。一些抗血管生成药物已经在铂敏感复发性卵巢癌中显示出疗效,但是唯一被批准的用于卵巢癌的药物是贝伐单抗,它在新诊断和复发的情况下都被证明是有效的。在铂敏感复发卵巢癌中,对于适合铂类药物再治疗的复发性卵巢癌患者,批准的与贝伐单抗联合使用的化疗方案为吉西他滨-卡铂(基于OCEANS试验)和紫杉醇-卡铂(基于GOG-0213试验)。
在本研究(AGO-AVAR2.21)之前,广泛应用的铂基联合方案,CALYPSO的聚乙二醇脂质体阿霉素-卡铂方案,仅在单臂2期研究中与贝伐单抗联合,发现贝伐单抗-卡铂-聚乙二醇脂质体阿霉素对铂敏感复发卵巢癌患者是一种有效且耐受良好的方案。因此,设计了一项试验,确定与贝伐单抗联合的最合适的铂类方案,以确定使用卡铂-聚乙二醇化脂质体阿霉素的无进展生存是否优于卡铂-吉西他滨联合贝伐单抗方案。
2.方法
患者
本研究是由德国妇瘤小组(AGO)发起,欧洲妇科肿瘤网络协作组(ENGOT)和妇科恶性肿瘤协会(GCIG)组成的多中心,开放标签,前瞻性随机III期临床研究,包括德国、法国、澳大利亚、奥地利和英国在内的159个中心。符合条件的患者经组织学证实为卵巢上皮癌、原发性腹膜癌或输卵管癌,以铂类为基础的一线化疗后首次疾病复发超过6个月。其他入选标准包括:年龄18岁以上,复发后行肿瘤细胞减灭术以及前线使用过贝伐都是允许入组的。主要排除标准为:既往复发接受过化疗;低度恶性潜能卵巢肿瘤(交界性肿瘤);第一次贝伐单抗使用前4周内进行手术;在研究治疗期间或4周内计划进行手术;既往抗VEGF治疗相关的腹腔瘘、胃肠道穿孔、腹腔脓肿史。
研究设计
将符合条件的患者随机分配接受卡铂-吉西他滨-贝伐单抗(标准治疗组)或卡铂-聚乙二醇脂质体阿霉素-贝伐单抗(实验治疗组)。标准治疗组:贝伐单抗第1天15mg/kg,吉西他滨1000mg/m2第1天和第8天,和卡铂AUC4第1天,每3周为一个周期重复6个周期,然后静脉单药维持贝伐单抗相同剂量(每3周15 mg/kg),直到疾病进展或不可耐受的毒性。实验治疗组:贝伐单抗10mg/kg在第1和第15天,卡铂AUC 5第1天,和聚乙二醇脂质体阿霉素30mg/ m2第1天,每4周为一个周期,最多6个周期,随后是单药维持贝伐单抗15mg/kg每3周,直到疾病进展或不可耐受的毒性。对于复发性疾病,如果在减瘤手术后4周内开始化疗,可以省略第一剂贝伐单抗。
研究人员在筛查时对肿瘤进行评估,然后每12周评估一次,持续至少30个月(或直到疾病进展)。在研究治疗期间,每3周或4周评估CA-125,疾病进展、不可接受的毒性或30个月的随访后再每3个月进行一次CA-125评估。生活质量评估使用QLQ-C30和QLQ-OV28评分。
研究终点
主要终点是研究人员根据RECIST 1.1评估的无进展生存期,定义为从随机化到首次记录的疾病进展或死亡之间的间隔。次要终点为总生存率(OS),无生化进展的生存期(根据GCIG标准定义的CA-125水平)生活质量,安全性和耐受性。
3.研究结果:未证明NACT+IDS的非劣效性
2013年8月1日至2015年7月31日,共纳入682例患者。患者随机分组(标准治疗组337例给予卡铂-吉西他滨-贝伐珠单抗,实验组345例给予卡铂-聚乙二醇脂质体阿霉素-贝伐珠单抗),为意向治疗人群(ITT)。其中,661名患者接受了研究治疗(标准组329名,实验组332名)(图1)。标准组的329例患者中256例(78%)和实验组的332例患者中225例(68%)接受了继续贝伐单抗维持治疗。两组中都有近半数的患者曾接受过抗血管生成治疗,主要是贝伐单抗(表1)。在最终分析的数据截止时间(2018年7月10日),20名患者(3%;在标准组337例和实验组345例中,分别有5例(1%)和15例(4%)停止了所有的研究治疗。治疗暴露的详细情况见(表2)。
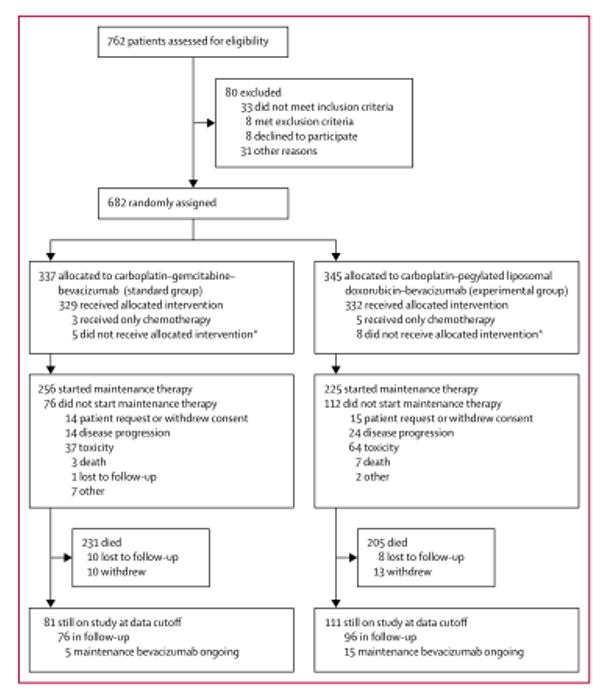
图1
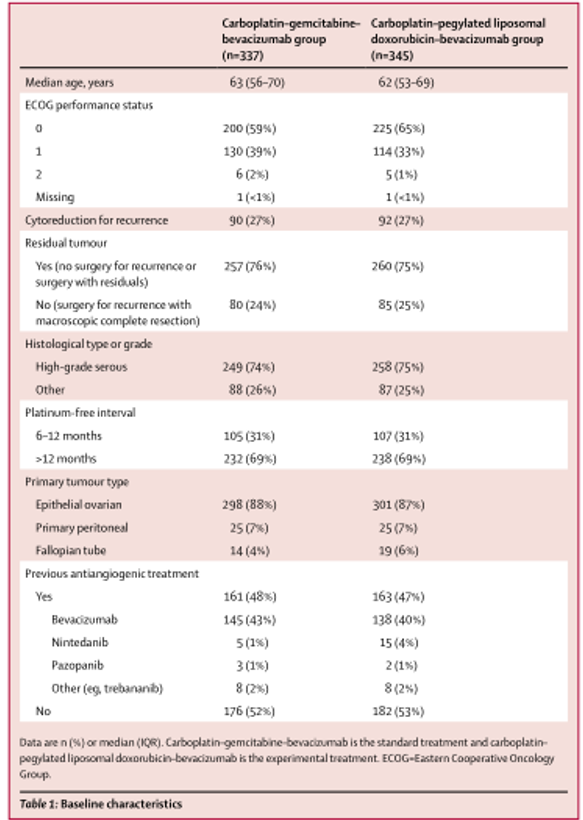
表1
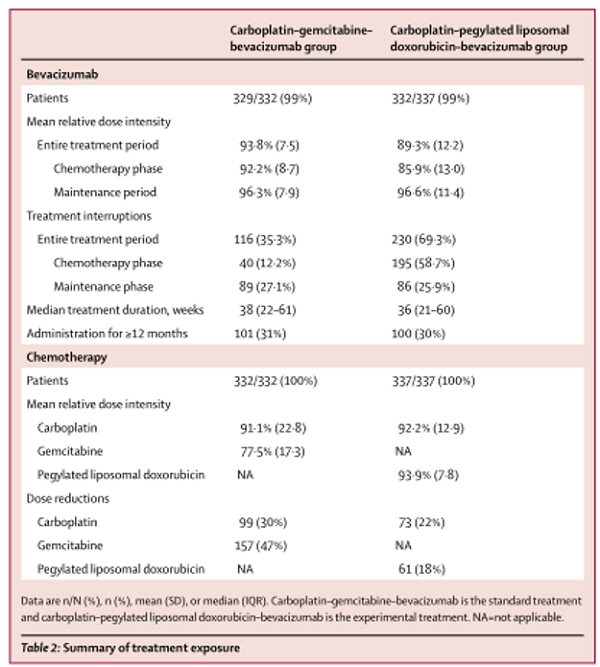
表2
无进展生存的中位随访时间标准组为11.3个月(IQR 8.0-18.4),试验组为12.4个月(8.3 - 21.7)。在数据截止时,记录了571例(84%)患者的PFS事件(标准组337例患者中有294例[87%],实验组345例患者中有277例[80%])。实验治疗组中位无进展生存期为13.3个月(95% CI 11.7 - 14.2),标准治疗组为11.6个月(11.0 - 12.7)(HR 0.81,95% CI 0.68-0.96); p = 0.012;图2A)。
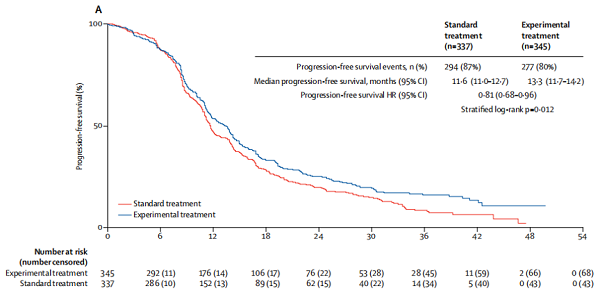
图2A
实验治疗组总生存中位随访时间为27.8个月(IQR 15.6-36.8),标准治疗组为25.5个月(14.5 - 35.5)。在439例(64%)死亡中(试验组345例中207例[60%],标准组337例中232例[69%]),试验组中位总生存期为31.9个月(95% CI 28.5-34.8),而标准组中位总生存期为27.8个月(25.5-30.2)(HR 0.81,95% CI 0.67-0.98; p = 0.032;图2B)。
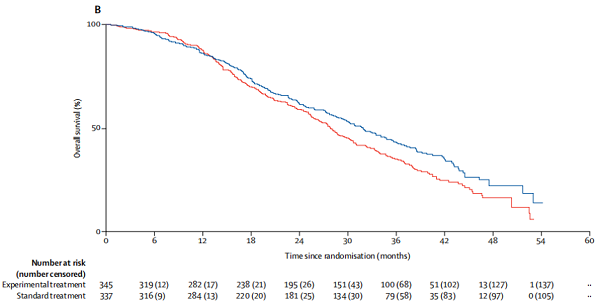
无生化进展生存期观察到的结果与无进展生存期(PFS)观察到的结果相似。583例患者(实验组345例中283例[82%],标准组337例中300例[89%])。实验组的中位无生化进展生存期为11·5个月(95% CI 10·6-12·5),而标准组为10·0个月(9·0 - 10·7)(HR 0·76,95% CI 0·64-0·90)。
预后相关的探索性亚组中无进展生存的单变量亚组分析如图3A所示:实验组在无铂间期大于12个月和前线应用了抗血管生成治疗两个亚组的获益显著优于标准治疗组。次要终点总生存期的单变量亚组分析如图3B所示:实验组仅在无铂间期大于12个月一个亚组中的获益显著优于标准治疗组。
生活质量评估的符合率在基线时很高(标准组为91%,实验组为86%),随着时间推移, 平均QLQ-C30全球健康状况评分在标准组的第3个月和实验组的第6个月达到峰值,随后都未达到基线水平。
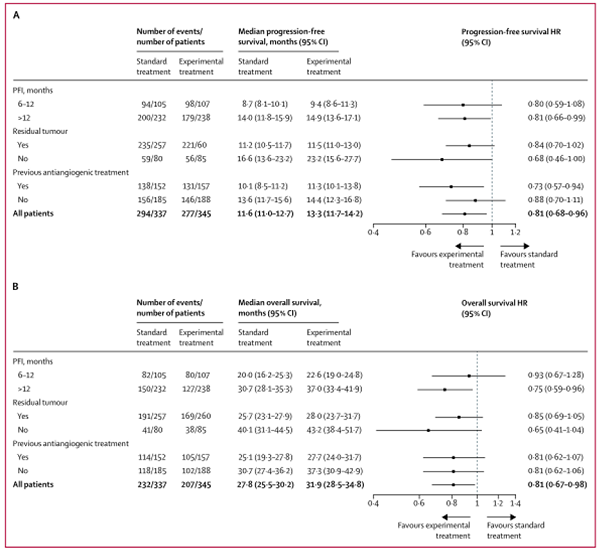
图3A和3B
几乎所有661名接受治疗的患者在研究期间都至少有一次不良事件(标准组329名患者中有319例[97%],而实验组332名患者中有327例[98%])。3级以上的不良事件在标准治疗(267[81%]的329)比实验治疗(250[75%]的332)更常见。10例患者发生致命不良事件:标准组6例(2%)(2例急性肾损伤,渗透性脱髓鞘综合征、颅内出血、身体健康恶化,和自杀各1例)和4(1%),实验组(肠梗阻、大肠穿孔、心肾功能衰竭,疾病相关的全身健康恶化各一例)。最常见的3级或4级不良事件是高血压(实验组332例患者中的88例[27%]vs标准组329例患者中的67例[20%]和中性粒细胞减少症(40例[12%]vs 73例[22%])。标准组329例患者中有28例(9%)发生严重不良事件,实验组332例患者中有33例(10%)发生严重不良事件。不良事件导致标准组329例患者中的78例(24%)和实验组332例患者中的104例(31%)停止治疗(表3)。
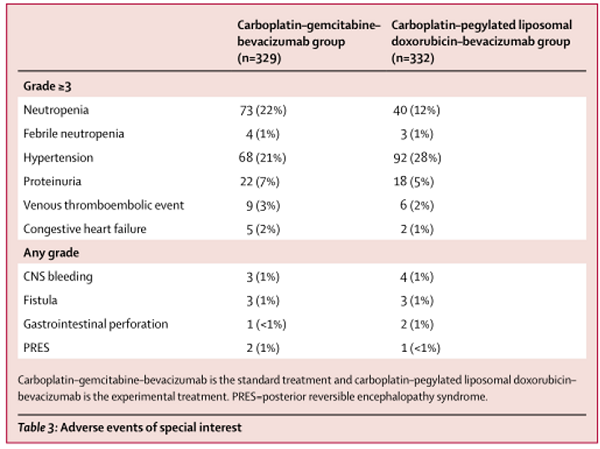
表3
4.研究讨论
试验表明,对于符合再次铂为基础治疗条件的复发性卵巢癌患者,与OCEANS试验中卡铂-吉西他滨-贝伐珠单抗标准方案相比,卡铂-聚乙二醇脂质体阿霉素-贝伐珠单抗实验方案可延长无进展生存期。这是第一个治疗复发卵巢癌方案中比较两种含有贝伐单抗方案的III期试验。两组治疗的安全性与贝伐单抗和化疗的已知副作用是一致的。正如预期的,含吉西他滨的标准治疗组有更多的3级以上不良事件,在两组中致命的不良事件很少发生。两组不良事件的差异包括实验组3级高血压发生率高于标准组,而3级中性粒细胞减少低于标准组。
试验中的相对剂量强度(吉西他滨为78%,卡铂为91-92%)和中位治疗持续时间(贝伐单抗为36-38周)与OCEANS试验(贝伐单抗的中位12个周期)和AGO-OVAR2.5试验(吉西他滨为76%,卡铂为96%)相似。聚乙二醇脂质体含阿霉素方案有更显著的无进展生存率和总体生存率。虽然交叉比较的局限性,但标准组的中位无进展生存期为11·6个月与在OCEANS中(12·4个月)非常相似。
如今PARP抑制剂已成为铂敏感复发性卵巢癌患者维持治疗的标准治疗。PARP抑制剂olaparib、niraparib和rucaparib被批准作为铂敏感复发卵巢癌患者的维持治疗,在brca突变肿瘤患者中显示出最佳的疗效。因此,在我们的试验中,没有PARP抑制剂是一个局限因素。此外,本试验缺乏BRCA突变状态的信息也是一个不足。虽然在设计本试验时,BRCA检测和PARP抑制还不是常规推荐,但现在已建议所有非粘液性卵巢癌患者进行BRCA检测。因此,在我们的试验中,治疗组之间任何BRCA突变状态的潜在不平衡都可能会造成一定的结果偏差。试验表明,在试验方案下,总体生存率有显著提高。然而,该试验并非旨在评估疾病进展后后续治疗的效果,因此进展后治疗的潜在不平衡可能会影响总体生存结果。
总之,这些结果表明,卡铂-聚乙二醇脂质体阿霉素-贝伐单抗可以成为复发性卵巢癌患者一种新的标准治疗方案。
5.总结
1. 本研究以及OCEANS,GOG0213研究的PFS计算是从化疗开始,即包括化疗,维持治疗两个阶段。虽然本研究实验组PFS取得了阳性结果,但与标准治疗组相比仅1.7个月的获益,即使加用贝伐比单用化疗延长了更多PFS,但是获益仍然有限。与PARP抑制剂维持治疗获益程度相比仍然存在一定差距。
2. 本研究在欧洲开展,入组患者均为首次PSR的患者,并且从研究的亚组分析看,有近半数患者在前线治疗接收过抗血管的治疗。考虑到贝伐单抗的获益程度以及不良反应和患者的耐受程度,依从性,卫生经济学等问题,贝伐单抗在欧洲的应用情况与中国的应用现状可能存在一定的差异。
3. 2020NCCNv1对于初治卵巢癌维持治疗的推荐根据前线是否联合贝伐化疗分为两个路径。前线应用联合贝伐化疗方案的BRCA野生型的患者达到CR/PR后推荐了奥拉+贝伐或者贝伐单药维持治疗两个方案。PARP抑制剂单药在此人群并未被推荐主要原因从证据角度分析可能为PRIMA前线未入组使用过贝伐单抗的人群。但是从铂敏感复发维持治疗的两个研究看:NOVA(~25%前线使用了贝伐)和ARIEL3(~23%前线使用了贝伐),证实了贝伐在前线的应用并不影响PARP抑制剂在PSR人群维持治疗的疗效,并且NOVA及ARIEL3的患者PFS获益程度较本研究以及OCEANS,GOG0213有很大优势。
4. 临床上贝伐单抗或PARP抑制剂的应用要根据患者个体化的情况(基因突变状态,复发风险等),进行细致筛选,才能使患者进入到精准治疗的时代,使我们的每一个患者在现有的医疗环境下接受到适合他们的最优治疗方案。

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
