对于III/IV期卵巢癌、输卵管癌和原发性腹膜癌的初始肿瘤细胞减灭术(PDS)和新辅助化疗(NACT)+中间性肿瘤细胞减灭术(IDS)的比较,EORTC55971和CHORUS研究已证实NACT可降低肿瘤侵袭性,且对比PDS显示出总生存期(OS)的非劣效性。2020年3月,III期临床试验JCOG0602研究的最终结果在European Journal of Cancer杂志发表。本期特别邀请来自山东大学第二医院妇科的朱琳教授对该研究进行解读。

朱琳 教授
主任医师
硕士研究生导师
山东大学齐鲁第二医院妇科主任
卫生部妇科内镜四级手术培训基地主任
中国医师协会妇科内镜医师专业委员会副主任委员
中国医师协会内镜医师分会常委
中国医师协会妇产科分会委员
国家卫计委妇科内镜诊疗技术专家组成员
山东省医师协会妇科腹腔镜医师分会主任委员
山东省医师协会妇科内镜培训学院院长
山东省医师协会妇产科分会副主任委员
山东省医学会妇科肿瘤学分会副主任委员
山东省抗癌协会理事兼妇科肿瘤分会副主任委员
山东省医师协会妇科微创分会副主任委员
山东省医师协会女性盆底功能障碍性疾病分会副主任委员

 00:000:00 音频
00:000:00 音频 1.研究背景
上皮性卵巢癌、输卵管癌或腹膜癌在妇科恶性肿瘤中预后最差。诊断时多为晚期,5年生存率低于35%。晚期肿瘤的标准治疗方法是PDS及含铂化疗。尽管我们一直在追求R0或满意的肿瘤细胞减灭术,但在绝大多数机构中只有25%-40%的患者实现了满意减瘤术。
为了进一步研究NACT+IDS的疗效,在欧洲和日本进行了至少三项比较PDS与NACT+IDS的随机试验(表1)。
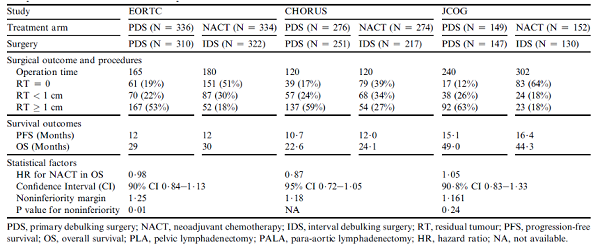
表1 三项III期临床试验主要结果对比
2.JCOG0602研究设计:多中心、III期、随机、开放标签、非劣效性临床试验
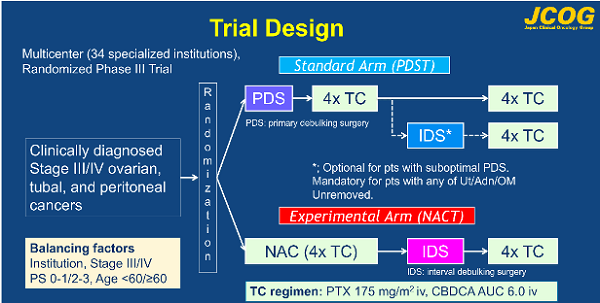
2006年11月到2011年10月,共入组301名患者。
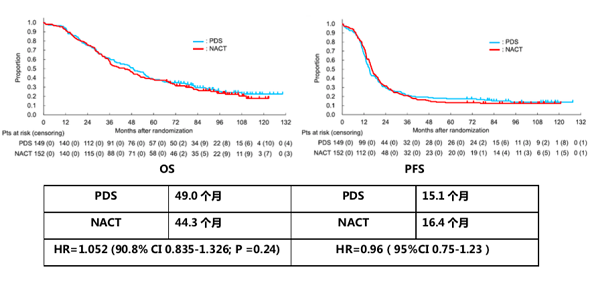
3.研究结果:未证明NACT+IDS的非劣效性
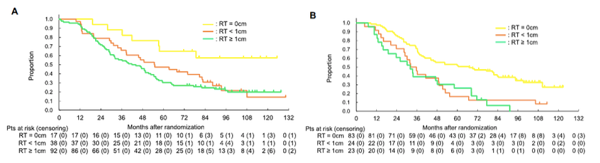
A、B图分别显示PDS组和NACT组不同手术残留情况(无残留、残留<1cm、残留≥1cm)的OS。在PDS组分别为未达、54.9个月、43个月;在NACT组分别为67个月、34个月、32个月。
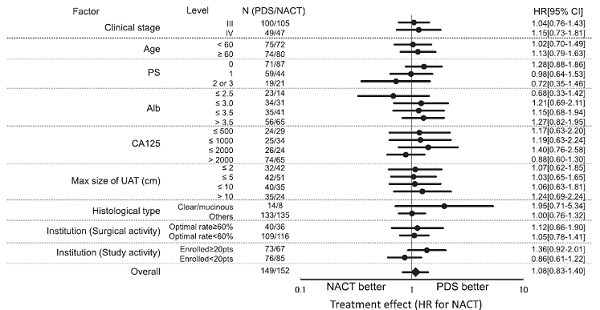
4.探索性分析
在PS评分低(2-3分),白蛋白低(≤2.5g / dL)和CA125高(> 2000 U / mL)的亚组中,NACT的HR值显着降低,而在化疗抵抗的组织学类型(透明细胞癌和粘液癌)中NACT的HR值较高。但各亚组均未显示出统计学差异。
5.PARP抑制剂联合免疫治疗
与先前的III期随机研究(EORTC5597和CHORUS)结论不同的是,这项研究未明确NACT相比于PDS的非劣效性。可能的原因:不同的研究设计,治疗方案和手术情况等。
本研究PDS组中进入到IDS的患者比例更高(33%,EORTC研究是17%,CHORUS研究未描述)。原因之一是与以往的研究相比,该研究中PDS的完全切除率和满意减瘤率较低。另一个原因是该研究中IDS适应症更广泛——允许未达理想PDS的患者接受IDS,且强制在PDS无法切除子宫,附件或大网膜时必须进行IDS。在CHORUS试验中,行IDS的患者由随机分组产生,这可能会排除一部分需行IDS的患者。一项Cochran荟萃分析显示,IDS获益仅针对未经专业医师满意减瘤的患者,这意味着PDS不满意的患者可能会受益于IDS。而本研究中PDS不满意切除率很高,PDS组中的更多患者可能会从IDS受益。从而改善PDS组的总生存。
本研究未证实NACT在IV期患者中有明显生存获益。这可能与EORTC 55971与CHORUS研究中PDS术后死亡率较高有关(2.5%和6.0%,本研究0.7%)。
NACT周期数多可能诱导更频繁的化疗抵抗。本研究新辅助化疗的周期数为四个周期,不同于前两个研究的三个周期。本研究中NACT组的进展后生存期比PDS组缩短了6个月,而前两项研究几乎相同,因此推断四周期NACT可能诱导了更高的化疗耐药性。
NCCN指南建议对评估达到满意减瘤术可能性较低或不适合手术的患者,应进行NACT。NACT也被认为是更安全的治疗方案而广泛接受。然而,NACT并不一定很好的替代PDS,临床应根据可切除性、耐受性及组织学类型进行综合判断。

研究局限性:样本量较以往研究小,且统计效能低至73%。其次,本研究也不适合讨论NACT的组织学类型。

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
