【据《Cancer Cell》2020年2月报道 作者:Zhiyuan Hu等】

张瑜 教授
医学博士、主任医师
博士研究生导师
湘雅医院妇产科教研室主任兼妇科主任
中国优生科学协会阴道镜和宫颈病理学分会常务委员
中国医师协会妇产科医师分会阴道镜及宫颈病变专业委员会委员
湖南省抗癌协会妇科肿瘤分会常委
湖南省医学会妇产科分会阴道镜与宫颈病理学组组长
湖南省女性生殖道感染性疾病专业委员会副主任委员
湖南省妇科肿瘤专业委员会委员
中国妇幼保健协会妇幼微创专业委员会委员

 00:000:00 音频
00:000:00 音频
肿瘤内异质性(intratumor heterogeneity)是肿瘤生存和进化的关键机制。遗传异质性已被认为是大多数癌症类型的生存机制。然而,即使具有相同遗传背景的癌细胞也可能具有不同的细胞表型,从而促进癌症的侵袭、转移和对化疗的耐药性等特性。
高级别浆液性卵巢癌(HGSOC)是致死率最高的妇科恶性肿瘤,这类肿瘤通常具有TP53突变和染色体的异常。并且,大部分卵巢癌病人在晚期才被发现,5年生存率只有30%左右。缺乏有效的方法来对HGSOC分类一直是卵巢癌治疗的一大难题。先前的研究已表明HGSOC的转录组异质性,但是大量转录体的分析会受到多种因素的干扰,例如拷贝数的变化和非癌细胞的污染。并且,这些分析没有考虑到一个肿瘤中多种细胞共存的可能性。这些混杂因素导致无法准确的将肿瘤分型来分析病人的预后。
最近大量研究证据表明SOC起源于输卵管上皮(FTE),研究报道了FTE由PAX8阳性分泌细胞、TUBB4阳性纤毛细胞和CD44阳性基底细胞组成。然而,是否还有其他的细胞亚型,这些亚型是否与HGSOC亚型有关,仍然是个谜。单细胞RNA测序(scRNA-seq)的出现使细胞亚型的识别成为可能。本研究就利用一种深度单细胞RNA测序技术Smart-Seq2对人类FTE的细胞亚型进行了鉴定,并探讨了与卵巢癌病人预后的关系。
研究者首先使用Smart-Seq2技术分析了5名卵巢癌患者和5名子宫内膜癌患者输卵管中的3877个单细胞(图1A)。在测序前采用流式细胞仪对单个FTE细胞(EpCAM+,CD45-)、白细胞(EpCAM,、CD45+)和基质细胞(EpCAM,、CD45-)进行鉴定和分类。为了排除临床样本中混杂的批处理效应和患者特有的变异性,他们使用了基于差异表达的聚类分析(图1B)。利用这种方法来区分上皮细胞和非上皮细胞(图1C)。为了了解细胞维持方法的影响,作者比较了新鲜和培养的FTE细胞的单细胞转录体。此外,三种条件下的假时间分析显示,与隔夜(overnight)培养组相比,长期培养(LT)细胞的转录本更类似于新鲜细胞(图1D和1E)。因此,为了避免保存方法带来的这些影响,研究者只对新鲜细胞进行下游分析。
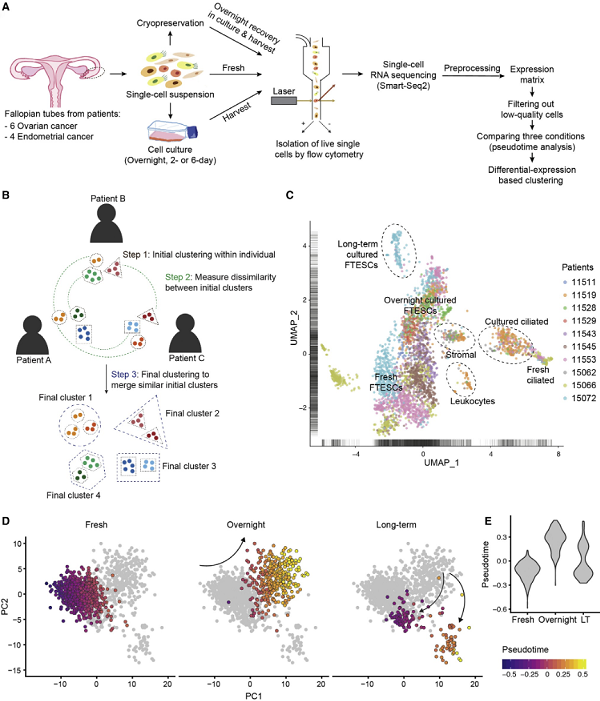
图1 对人输卵管细胞的筛选
研究者接下来将新鲜的FTE细胞(2132)按先前建立的两个亚型分类:分泌细胞(1986)和纤毛细胞(146)(图2A)。然后,再根据它们的转录体识别出分泌细胞亚型(图2)。应用上述基于差异表达的聚类方法,在分泌细胞群中识别出9个具有不同转录谱的类别(cluster)。排除掉患者特异性(图2B)、没有差异和细胞应激可能的5个类别后,将分泌细胞分为了4种亚型(图2C-F):1. 细胞周期亚型,主要是以下三种途径的基因表达上调,即细胞周期(如MCM2-7、MKI67、TK1和STMN1)、DNA修复(如FANCD2、FANCI和MSH2)和染色质重建;2. 分化亚型细胞,其RNA合成和运输途径相关的基因显著增加,并且与细胞周期亚型细胞有相同的几个标记物,这代表着细胞分裂后短暂的分化细胞群;3. KRT17亚型,其特征是主要组织相容性复合物(MHC)II类基因(例如,HLA-DQA1、HLA-DPA1和HLA-DPB1)、细胞角蛋白(KRT17和KRT23)、醛脱氢酶(ALDHs)等的表达上调,代表着一组具有重要生物学功能的细胞;4. 上皮-间质转化(EMT,epithelial-mesenchymal transition)亚型,其特征是高表达G蛋白信号调节因子和细胞外基质途径的基因。接着,作者为了排除癌细胞对非癌FTE细胞的潜在旁分泌作用,进一步验证了在良性标本FTE细胞中存在四种分泌亚型(图3)。另外,作者还发现了1种分泌-纤毛中间态细胞亚型以及1种特殊的组织原位T细胞(图4)。
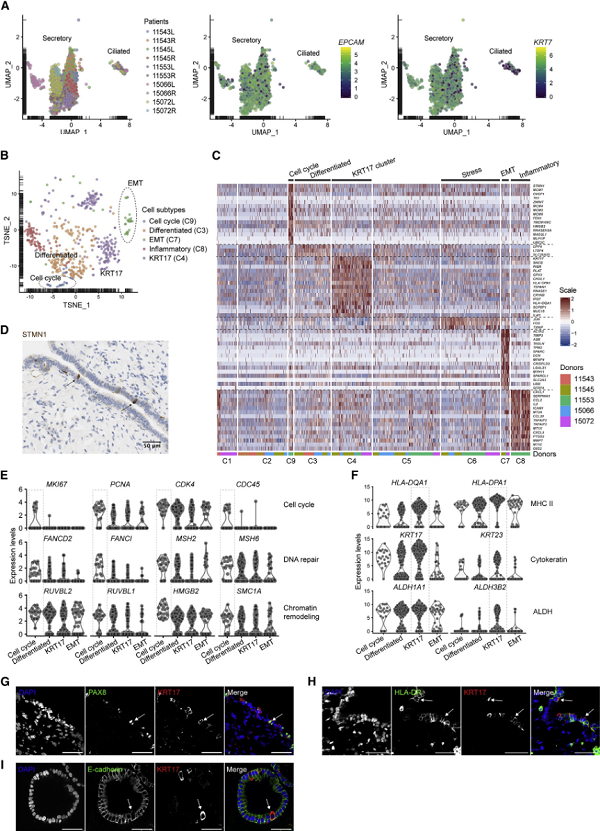
图2 FTE细胞的单细胞RNA测序显示出四种分泌亚型
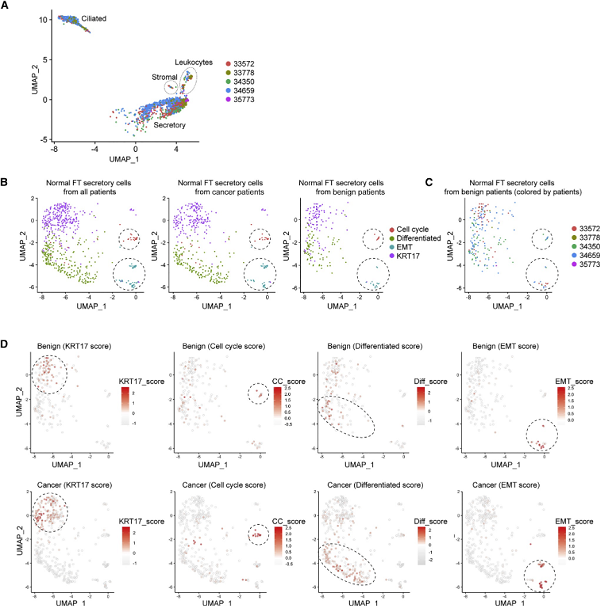
图3 在良性标本中验证FTE的分泌细胞亚型
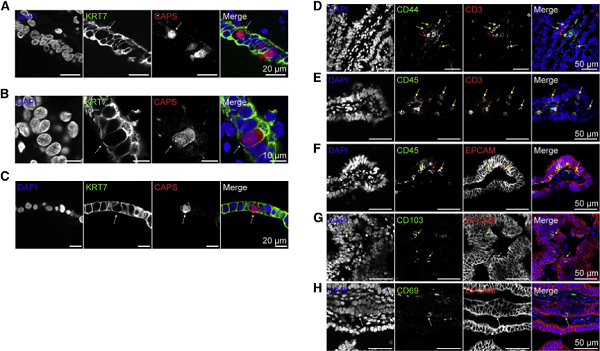
图4 输卵管上皮非传统细胞亚型
基于对FTE单细胞转录体的分析,作者从上述五个主要FTE细胞亚型(细胞周期、EMT、分化、KRT17和纤毛)的转录组中提取出一个由52个标记基因相对表达量组成的参考矩阵(图5A)。随后,将所得参考矩阵利用支持向量回归模型对TCGA,AOCS等九个公共数据库中大量的HGSOC RNA-seq数据进行反卷积分析,以计算每个癌组织中五种细胞亚型的比例。根据数据集中细胞亚型的比例,这样的“分解”显示了肿瘤内的异质性(图5B-E)。值得注意的是,研究者们在多个数据集中发现了一类高EMT(EMT-high)的肿瘤。这些肿瘤高表达与之前被定义为“间充质”HGSOC亚型相关的基因。他们发现这些肿瘤的标记基因在细胞外基质、局灶性粘附和PI3K-AKT信号传导途径中富集。此外,三个关键的EMT转录因子TWIST1、TWIST2和SNAI2在EMT-high型肿瘤中上调(图5G),而抑制EMT的miRNA-200家族(miR-200a、miR-200b、miR-200c、miR-141和miR-429)在EMT-high型肿瘤中(图5H)表达下调,提示EMT可能是该肿瘤亚型间充质癌细胞富集的潜在机制。接下来,他们进一步发现EMT细胞亚型的比例和病人预后明显呈负相关(图6A),且这一相关性在九个独立数据库中都可被重复出来。
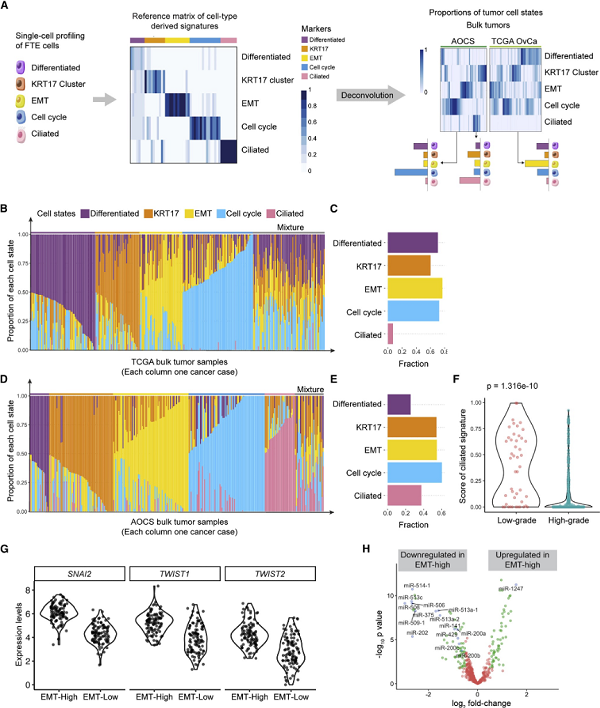
图5 反卷积分析揭示浆液性卵巢癌表型异质性
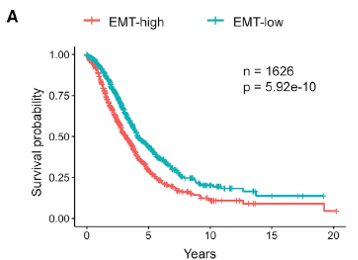
图6 Kaplan-Meier曲线显示EMT评分对生存率的影响。
为了进一步证明EMT及其他四种细胞状态的信号可来自于癌细胞,研究者们利用激光捕获显微切割技术(LCM)获取了纯度更高的肿瘤样本,并进行了转录组测序,对LCM样本数据分析重现了在TCGA等公共数据库里的发现,并通过免疫荧光染色在组织切片和卵巢癌细胞系KURAMOCHI中进行了验证。
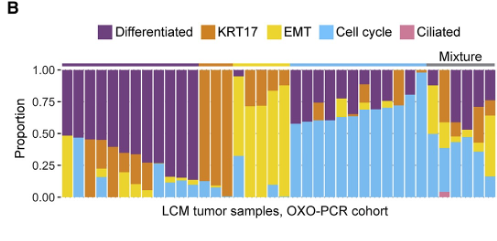
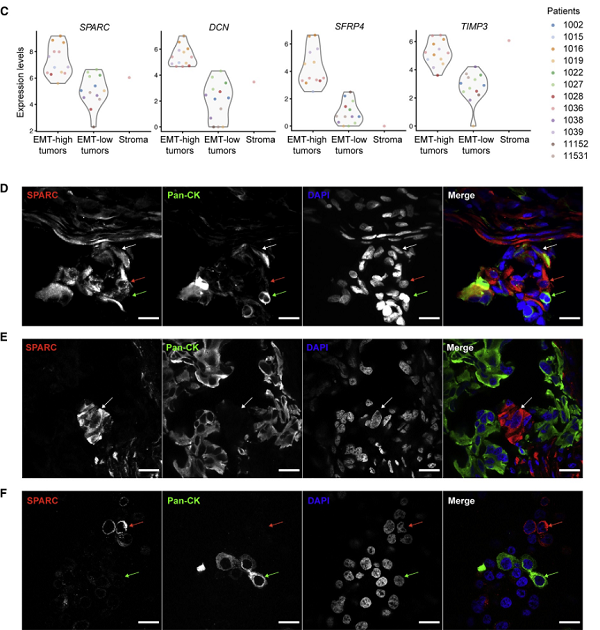
图7 高EMT肿瘤包括间充质样的癌细胞
总之,这项研究通过对6000多个单细胞的深度测序,确定了输卵管上皮细胞亚型,显示了浆液性卵巢癌起源——人类输卵管上皮组织新的细胞“蓝图”,再将FTE亚型投射到肿瘤上以帮助SOC的精确分子分型,并且定义了一个不良预后的EMT-high亚型。这项研究对卵巢癌的预后分析带来重要影响,并且对EMT-high肿瘤亚型的临床治疗方法开发带来启发。通过反卷积的分析方法,发现癌症的细胞状态可以由来自正常来源细胞的细胞状态来反应,具有极高的应用价值。
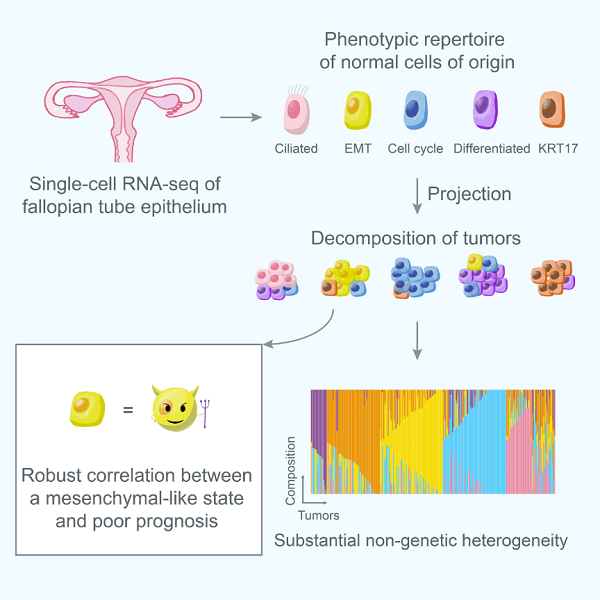
文章整体思路(本图来自于作者推特)

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
