免疫检查点阻断(ICB)是目前肿瘤治疗研究的一个热点,其在许多难治型肿瘤的治疗中也取得了持续的反应。
目前多种PD-1和PD-L1的抑制剂已经被FDA批准上市,主要用于恶性黑素瘤,非小细胞肺癌(NSCLC)等多种恶性肿瘤的治疗。目前尚无FDA批准的PD-1/PD-L1用于针对卵巢癌的治疗,但许多针对卵巢癌的临床研究正在进行。卵巢癌病人是否能从免疫检查点抑制剂的治疗中获益呢?哪些生物标记物可以预测患者对治疗的反应呢?本文就这些热点问题进行了综述。

刘红 教授
副主任医师
硕士生导师
电子科技大学医学院附属肿瘤医院
四川省肿瘤医院妇科肿瘤中心转化研究室主任,副主任医师,硕士生导师
中国医师协会妇产科医师分会第三届委员会青年委员会委员
中国研究型医院学会妇科肿瘤专委会委员
中国妇幼保健协会妇科智能医学专业委员会委员
中国优生科学协会肿瘤生殖学分会委员
中国医药教育协会妇科专业委员会宫颈病变分会委员
中国中医药研究促进会中西医结合妇产与妇幼保健分会委员
四川省国际医学交流促进会妇科专业委员会常务委员
四川省抗癌协会妇科肿瘤专委会委员

 00:000:00 音频
00:000:00 音频 我们对多种生物标记物进行的研究,包括PD-L1在肿瘤组织中的表达、肿瘤突变负荷(TMB)和微卫星不稳定(MSI)、免疫细胞浸润如TILs, 基因表达特征等,但各种标记物均有其优缺点。
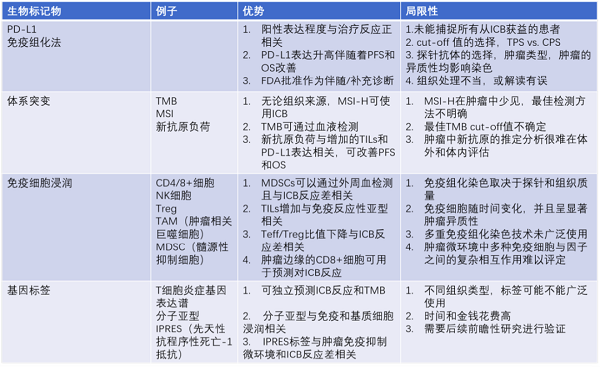
1.免疫组化检测PD-L1的肿瘤表达
免疫组化检测PD-L1的肿瘤表达在多项临床研究中作为筛选或分层标记物,并且部分结果显示,肿瘤组织PD-L1的表达情况与免疫检查点抑制剂的临床反应相关。
然而,在临床研究中我们也可以发现,许多PD-L1阴性的肿瘤显示出治疗应答,而PD-L1高表达的肿瘤并没有看到临床获益,这提示PD-L1肿瘤表达预测免疫治疗反应也有一定的局限性。
在不同的研究中发现PD-L1在卵巢癌中的表达存在差异,肿瘤中PD-L1的染色从11%-88%的表达不等。PD-L1肿瘤表达的差异可由多种因素造成,包括Cut-off值,不同的抗体,肿瘤细胞与免疫细胞的染色,疾病的分期,组织分级,病理类型和不同地域而有所不同。目前在卵巢癌中,单用免疫检测点抑制剂的客观反应率(ORR),仅在10-20%左右,PD-L1的表达是否与免疫检查点抑制剂临床反应相关,结论仍不清楚。
2.肿瘤浸润性淋巴细胞
肿瘤浸润淋巴细胞 (TILs),也显示与更好的临床反应相关。研究发现即使PD-L1表达水平升高,但组织中如果缺乏肿瘤浸润淋巴细胞TILs,对免疫检测点抑制剂治疗的反应也会很差。
卵巢肿瘤中肿瘤浸润淋巴细胞TILs数量增加,特别是侵入到肿瘤上皮细胞内的而不是癌旁组织或间质的肿瘤浸润淋巴细胞TILs数量增加可以改善预后。几项大型meta分析结果显示,上皮内CD3/CD8+ TILs与生存相关,无肿瘤浸润淋巴细胞TILs的患者生存更差,有肿瘤浸润淋巴细胞TILs的患者PFS更长。
最早,TPS评分(仅评估肿瘤PD-L1表达的指标)被用于非小细胞肺癌适用于免疫检测点抑制剂治疗的研究。但是PD-L1不仅在卵肿瘤细胞表达,也可在TILs和其他肿瘤微环境中的细胞中表达。因此,近来,联合评分指数CPS用于评估PD-L1表达(包括肿瘤和免疫细胞染色的指标)作为新的评估标准。
联合评分指数CPS更多的用于临床研究,特别是卵巢癌的临床研究。研究结果显示CPS与临床反应的相关性更好,可重复性更高。
3.基因表型
大规模的基因研究也尝试探索不同基因表达亚型是否与肿瘤的生物学行为有关,可用于预测临床预后和指导临床治疗。
在澳大利亚一项卵巢癌研究中最早发现高级别浆液性卵巢癌有独特的基因表达亚型。根据癌症基因组图谱研究网络的研究将卵巢癌分为四种分子亚型,免疫反应型,分化型,增殖型,间充质型。后续的研究发现,不同的分子表型其OS显著不同,其中免疫反应亚型的OS最长。PD-L1是免疫反应亚型中重要的组成部分,我们需要明确PD-L1免疫组化表达阳性与基因转录亚型的相关性,以更好的预测对免疫治疗的反应性。
未来,在PD-L1状态评估解释中,多基因标签可用于更广泛的免疫反应性评估,可能可以用于指导免疫检查点抑制剂的治疗。
结论
PD-1 / PD-L1免疫检查点抑制剂已在复发性和晚期卵巢癌中应用,并发挥了一定抗肿瘤活性。临床应用中最重要的挑战是选择合适的病人。随着对肿瘤微环境和卵巢癌分子表型的深入认识,可能弥补传统免疫组化检测用于预测免疫反应性的不足。
参考文献:Curtis D.C., et al. Biomarkers that may predict response to immunotherapy in ovarian malignancies. Curr Opin Obstet Gynecol 2019, 31.

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
