
胡琢瑛教授
主任医师
医学博士、硕士生导师
重庆医科大学附属第一医院妇科副主任
卫生部四级妇科内镜手术培训基地导师
重庆市中青年医学高端人才
重庆市医师协会宫腔疾病与微创生殖专委会常务委员
重庆市妇幼卫生学会妇科肿瘤学组副组长
重庆市抗癌协会妇科肿瘤专业委员会委员
中国妇幼保健协会妇科内分泌专业委员会青年委员
擅长妇科肿瘤、妇科内分泌及子宫内膜异位症的诊治。

 00:000:00 音频
00:000:00 音频 1、背景
卵巢癌是最致命的妇科恶性肿瘤,在2018年,全世界约有295414个新病例和184799人死亡。晚期上皮性卵巢癌(EOC)患者常出现大肿瘤和腹水,影响饮食摄入和肠功能;因此,患者往往在发病时出现营养不良或恶病质。严重的肌肉量减少(即骨骼肌减少)是癌症恶病质的重要组成部分,与各种恶性肿瘤的预后不良相关。肌肉减少症也常见于晚期上皮性卵巢癌(EOC)。然而,在初始减瘤手术(PDS)和含铂化疗期间,机体成分的变化对晚期EOC患者预后的影响尚不清楚。本研究旨在评估PDS和铂为基础的化疗对III期EOC患者的身体组成变化与预后的关系。
2、方法
患者
我们对2008年至2017年期间接受PDS和铂类化疗的FIGO分期 III期EOC患者进行了回顾。纳入标准如下:(i) PDS前的常规腹部CT和化疗后的第二次CT扫描。(ii)充分的CT扫描质量,准确测量组织面积。接受新辅助化疗或接受1 ~ 2个疗程化疗后拒绝继续化疗的患者不纳入研究。如果无法从患者的病历中获得相关的临床数据,也将患者排除在外。PDS的治疗结果分为完全(无肉眼残余瘤)、理想(最大残余瘤≤1 cm)和次理想(最大残余瘤>1 cm)。所有患者均建议每3周进行一次铂类化疗,共6个周期。PDS术后3周内开始化疗。在PDS前获得常规治疗前CT图像,化疗结束后6个月内获得治疗后CT图像。
基于CT的身体成分分析
检索治疗前后的CT图像进行分析。体重和身高是在初次和后续CT扫描后2周内从医疗记录中获得的。预先设定的Hounsfield unit (HU)阈值为:骨骼肌-29 ~ +150 HU,内脏脂肪组织-50 ~ -150 HU,皮下和肌肉间脂肪组织-30 ~ -190 HU。计算骨骼肌(包括腰大肌、椎旁肌、腹直肌、腹直肌、内外斜肌)和脂肪组织的横截面积(cm2)。整个骨骼肌横截面积的平均辐射衰减为骨骼肌放射密度(SMD)。总脂肪组织面积(TAT)为皮下脂肪组织、肌间脂肪组织、内脏脂肪组织面积之和。在本队列中随机选取的60例患者中,骨骼肌区域、SMD和TAT区域的观察者内变异系数分别为0.8%、0.8%和1.0%。根据患者身高将骨骼肌和TAT的横截面积归一化,确定骨骼肌指数(SMI)和总脂肪组织指数(TATI);cm2 / m2)。根据当前恶病质的定义,患者如有体重,SMI,SMD,或TATI的减少≥5%的情况将被定为“流失”(loss);患者体重、SMI、SMD、TATI减少< 5%或体重、SMI、SMD,或TATI增加则被定义为“维持”(maintenance)。
全身炎症标记物
在进行PDS前,进行了差异血细胞计数和血清白蛋白测定。中性粒细胞-淋巴细胞比率(NLR)定义为绝对中性粒细胞计数除以绝对淋巴细胞计数。NLR的分类使用的截止值为3(即≤3或>3)。血小板-淋巴细胞比率(PLR)定义为血小板绝对计数除以淋巴细胞绝对计数。PLR的分类使用的截止值为150(即≤150或>150)。收集127例患者的血清c反应蛋白(CRP)水平。改良的格拉斯哥预后评分(mGPS)是评估恶病质状态的一个有用的炎症指标,这个评分包括反映全身炎症状态的CRP水平和反映营养状态的血清白蛋白水平。
统计分析
主要终点为总生存期(OS),定义为从手术日期到任何原因死亡日期的时间;无进展生存期(PFS)定义为从手术之日起至疾病复发、进展或因任何原因死亡之日止的时间。生存曲线采用Kaplan-Meier法,log-rank检验。
3、结果
共有139例患者符合纳入标准(图1)。最后的分析包括139例患者的278次CT扫描。治疗前和治疗后CT扫描的中位时间为182天(IQR: 161-225天)。辅助化疗结束至治疗后CT扫描的中位时间为44天(IQR: 26-73天)。
图1
基线时的身体成分和治疗后的变化
表1总结了基线时的身体成分特征和治疗后的变化。总的来说,在经腹膜透析和化疗后,体重指数(BMI)和总脂肪组织指数(TATI)增加,而骨骼肌指数(SMI)和骨骼肌放射密度(SMD)下降。11名患者(7.9%)体重减轻≥5%,而48名患者(34.5%)都经历了SMI和SMD减少幅度≥5%。SMI和SMD的降低与BMI不相关。(Spearman ρ for SMI, 0.15; P = 0.07; ρ for SMD,0.02; P = 0.82)。TATI的变化与BMI呈中度相关性(Spearman ρ for TATI, 0.58; P < 0.001)。SMI变化与SMD变化的相关性较弱(Spearman ρ for SMD,0.22;P = 0.01)。
表1
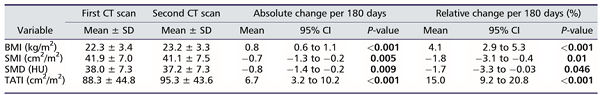
BMI, 体重指数;CI,置信区间;CT,计算机断层扫描;HU,胡恩菲尔德单位;SD,标准差;SMD,骨骼肌放射密度;SMI,骨骼肌指数;TATI,总脂肪组织指数.
全身炎症标志物和身体成分
图2显示了mGPS(炎症指标)和骨骼肌参数之间的联系。mGPS较高的患者治疗前SMD显著较低,治疗前SMI较低,有降低趋势,没有显著差异(p=0.06)(图2A和2B)。
图2:mGPS与(A)治疗前SMI,(B)治疗前SMD,(C)SMI的变化,(D)SMD的变化之间的关系
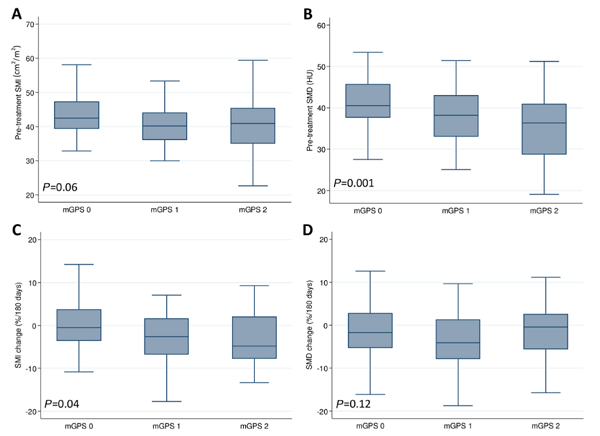
mGPS,改良格拉斯哥预后评分(炎症指标);SMD,骨骼肌放射密度;SMI,骨骼肌指数
主要终点
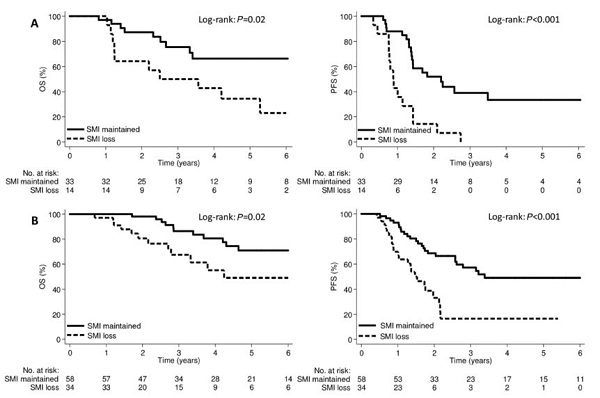
SMI-loss组与SMI-maintained的五年总生存率(OS)分别为44.4%和68.8% (P = 0.001); 五年的无进展生存率(PFS)分别为10.4% and 43.4%(P < 0.001; 图 3A)。
SMD-loss组与SMD-maintained的五年总生存率(OS)分别为49.8%和67.2% (P = 0.001); 五年的无进展生存率(PFS)分别为21.8% and 38.5%(P < 0.001; 图 3B). 。
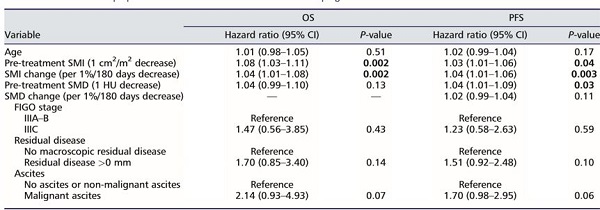
亚组分析中显示无论在治疗前肌肉减少症组和无肌肉减少症组中,只要患者发生SMI-loss,其五年OS及PFS都会显著降低( 图 4)。SMD变化和FIGO分期是PFS的预测因子,但不是OS的预测因子。在多变量分析(表2)中,治疗前的SMI和SMI的变化与OS独立相关。治疗前的SMI和SMD以及SMI的变化与PFS独立相关。BMI和TATI以及BMI和TATI的变化与OS或PFS无关。
图3
(A)SMI变化的OS及PFS
(B)SMD变化的OS及PFS
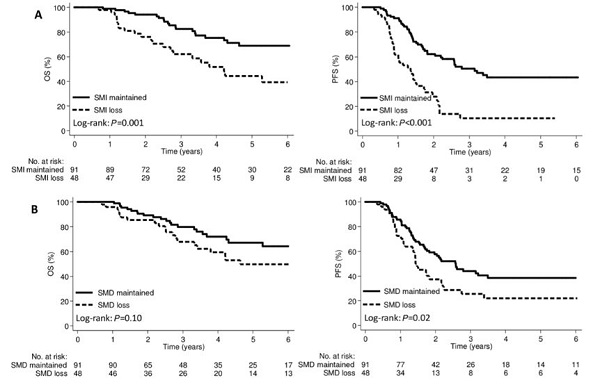
SMD,骨骼肌放射密度;SMI,骨骼肌指数
图4
(A)治疗前肌肉减少症组SMI变化的OS及PFS
(B)治疗前无肌肉减少症组SMI变化的OS及PFS
SMI,骨骼肌指数 (注:肌肉减少症的临界值为SMI< 39.2 cm2/m2、SMD< 35.5 HU和TATI< 100.8 cm2/m2)
表2:总生存率和无进展生存率的多变量Cox比例风险模型
mGPS,改良格拉斯哥预后评分(炎症指标);SMD,骨骼肌放射密度;SMI,骨骼肌指数
4、讨论
据研究者所知,这是首个对III期上皮性卵巢癌患者在接受PDS和化疗后通过CT进行纵向评估体成分变化的研究。我们发现在治疗过程中SMI和SMD下降;SMI和SMD的变化与BMI的变化不相关,表明肌肉损失是隐性的,并且独立于体重指数的变化而发生。SMI-loss的患者经历疾病复发的时间显著缩短。基线时的SMI和治疗期间的变化与不良生存结果独立相关,这表明使用常规癌症治疗获得的CT图像进行身体成分测量应纳入临床实践,因为它们可能有助于预测结果并潜在地指导癌症治疗。未来的研究需要基于个体身体成分表型和全身炎症标志物来评估癌症治疗和支持性护理的价值;这将有助于改善晚期卵巢癌患者的生存结果。

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
