近日ESMO会议公布了尼拉帕利卵巢癌一线维持PRIMA研究数据,跟NOVA研究结果一致,在没有HRD的情况下,尼拉帕利也能表现出临床益处,提示PARP在DNA损伤修复中的作用可能不是其发挥治疗潜力的唯一原因;同时,科学家们对PARP-1支持癌细胞生长的确切机制仍未知。2019年9月19日发表在《Molecular Cell》上的一篇文章揭示了PARP抑制剂在BRCA1/2正常表达状态下,仍能通过替代途径实现肿瘤的生长控制;在此项研究中,科学家们将目光放在了核糖体形成上。癌细胞依赖于核糖体进行爆炸性生长,而PARP抑制剂可影响核糖体的形成从而阻碍细胞增殖。今天,西安交通大学附属第一医院的杨筱凤教授将带我们一起详析这项研究的细节和结果。

杨筱凤教授
研究员、主任医师
医学博士、博士研究生导师
中妇幼全国妇女病防治委员会常委兼秘书
国家卫计委妇幼健康研究会常委兼秘书
陕西省医学会妇科肿瘤分会常委
陕西省医学会感染学组委员
中华医学会西安市妇产科学会委员
陕西省预防医学会妇女保健专业委员会常委
陕西省性学会妇产科学会常委
陕西省性学会妇科肿瘤学会常委
陕西省性学会阴道镜和宫颈细胞学会常委

 00:000:00 音频
00:000:00 音频 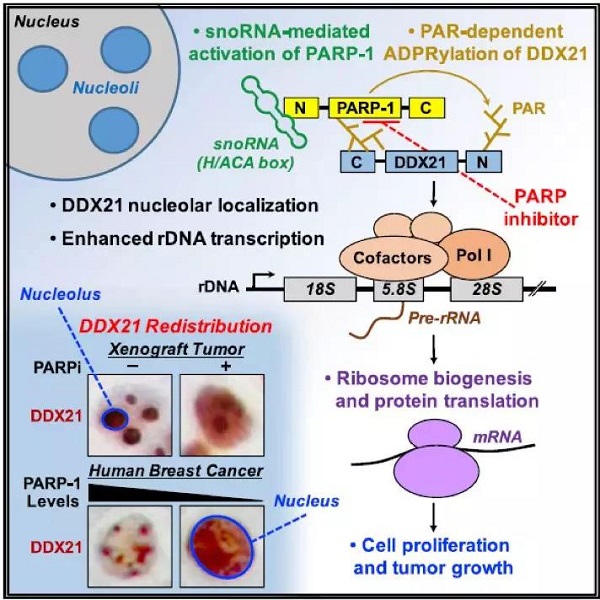
文章亮点:
1.PARP-1可与DDX21的结合,维持其功能并将其局限于核仁内
2.DDX21可以驱动核糖体生成
3.抑制体内PARP-1可以通过调节rRNA水平、DDX21功能和定位阻止核糖体形成,从而降低肿瘤细胞生长
实验结果
1.RIP-Seq 显示PARP-1 优先与核仁小RNA(snoRNAs)结合
RNA免疫共沉淀结合序列深度测序结果表明PARP-1优先结合核仁小RNA (snoRNAs),在乳腺癌细胞系MCF-7中,在没有UV交联的情况下,在免疫前的PARP-1IP实验中,就可以观察到细胞核RNA富集(如图1A所示),RNA-IP后RNA文库测序结果显示,尽管长链非编码RNAs和mRNAs是与PARP-1结合最多的RNA,snoRNAs仍旧是富集率最高的(图1B&1C);在MCF-7细胞中表达的46% snoRNAs与PARP-1结合;与含有C/D 盒子snoRNAs 相比,含H/ACA 盒子 snoRNAs 更优先与PARP-1结合(图1D)。
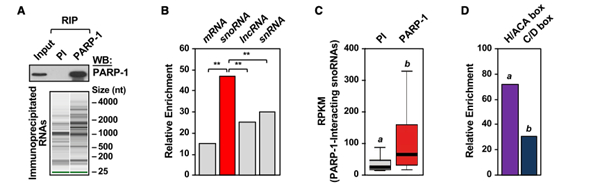
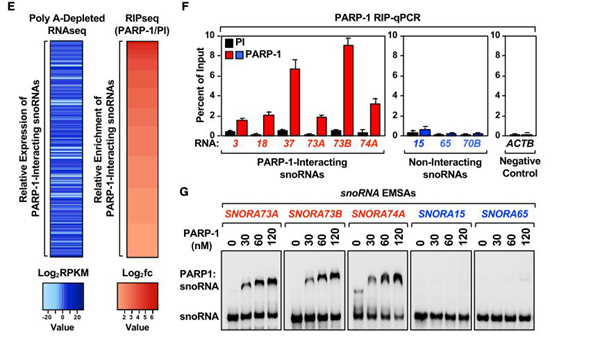
将snoRNA分选为正在与PARP-1作用的 snoRNAs和不与PARP-1作用的两个亚类(图1E),在PARP-1免疫前的IP实验显示,正与PARP-1作用snoRNAs明显富集(图1F),在乳腺癌细胞系MDA-MB-231, HCC-1143和T47D 中也可以看到这一现象,说明在不同类型细胞中,PARP-1-snoRNAs特定的相互作用非常保守。用P32 末端标记snoRNAs探针进行的RNA-EMSA(RNA-电泳迁移率变换试验)结果与RIP-Seq一致,特定的snoRNAs(例如SNORA73A, SNORA73B和 SNORA74A ) 在体外与PARP-1直接结合(图1G),而SNORA15 and SNORA65却不和PARP-1结合。
2.snoRNAs与PARP-1 DNA结合结构域作用可以刺激PARP-1的催化活性
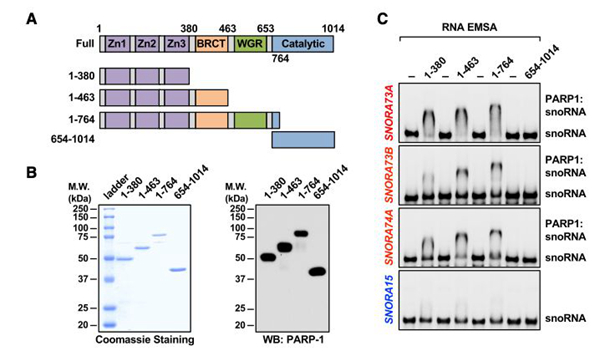
利用PARP-1结构域缺失突变体(图2A&2B)确定与snoRNAs相互作用的PARP-1功能区域,利用RNA-EMSA检测3个与PARP-1结合的snoRNAs(SNORA73A, SNORA73B&SNORA74A )一个不与PARP-1结合的snoRNA(SNORA15 ),结果表明PARP-1 DNA结合结构域必须和足够量的snoRNAs结合,而它的催化结构域不能和snoRNAs相互作用(图2C)(SNORA15不能与PARP-1任何结构域缺失突变体相互作用)。
为了解snoRNAs可能激活PARP-1的催化活性,在体外利用PARP-1自修饰(自动ADP核糖基化)检测,在超声剪切鲑鱼精子DNA(sssDNA)中加入烟酰胺NAD+后,重组PARP-1发生预期的自修饰 (图2D),转录的PARP-1与与之作用的snoRNAs(而非不能与PARP-1相互作用的snoRNAs)也同样可以使得PARP-1很好的自修饰(图2D)。EMSAs结果表明,snoRNAs介导活化事先自修饰的PARP-1,减弱了PARP-1后续结合snoRNAs的能力,PJ34处理后可以恢复PARP-1-snoRNAs相互作用。(图2E,2F)。
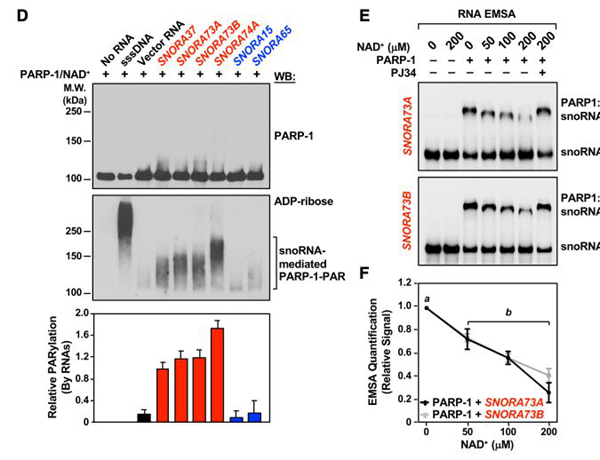
上述发现得出结论PARP-1-snoRNAs相互作用激活了PARP-1的催化活性和自修饰,造成PARP-1对snoRNAs亲和力降低,这也许是为了允许其他蛋白质的ADP核糖基化。
3.DDX21与PARP-1相互作用并被其ADP核糖基化
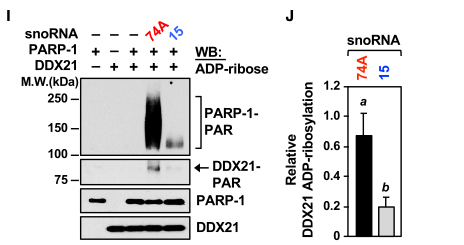
DDX21是DEAD-box家族RNA解旋酶,可以结合snoRNAs和rDNA染色质,调节rDNA转录。生化测定显示DDX21的确被PARP-1 ADP核糖基化,并对PJ34处理敏感(图3A);DDX21 N末端5个谷氨酸或门冬氨酸残基是PARP-1 ADP核糖基化位点(图3B)。丙氨酸(MutA)定点突变DDX21这些作用位点,突变体的ADP核糖基化明显弱于野生型(WT)DDX21(图3D,与在HEK293T细胞中FLAG-标签的MutA DDX21 的IP结果类似(图3E),也进一步肯定了DDX21 N末端的ADP糖基化位点。

在MCF-7细胞中的DDX21 的IP显示,DDX21与内源性PARP-1相作用并被其ADP核糖基化,PJ34处理可以减少DDX21 ADP核糖基化,与之相应PARP-1的IP也得出类似结果(图3f)。说明DDX21与 PARP-1的相互作用是PARP-1催化活性的前提。DDX21与多聚ADP核糖(PAR)结合牢固而不与未修饰的PARP-1结合(图3G),利用重组DDX21 pull-down测定也说明了DDX21与自修饰而非未修饰的PARP-1结合(图3H),ARH3k能够抑制DDX21与自修饰PARP-1相互作用,说明多聚ADP核糖(PAR)在PARP-1-DDX21相互作用中是必需的。
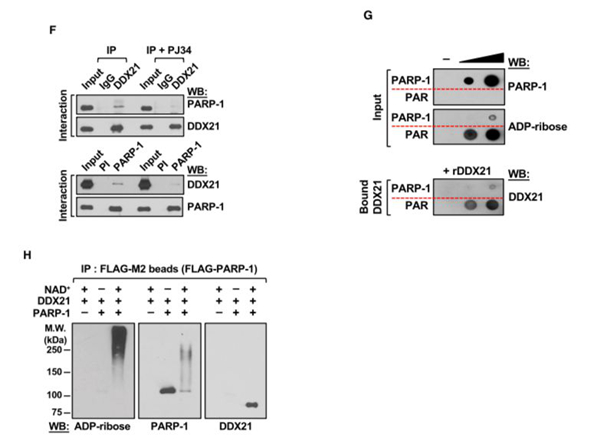
在此二者的作用体系中加入能与PARP-1相互作用的SNORA74A,PARP-1发生强烈的自修饰并可以使得DDX21 ADP核糖基化,而不与PARP-1相互作用的SNORA15不能刺激PARP-1自修饰或者DDX21 ADP核糖基化。UV诱导的PARP-1自修饰增加了它与DDX21的结合能力,说明无论由何种刺激物促进了PARP-1的活性,多聚ADP核糖(PAR)都是DDX21-PARP-1相互作用中一个重要的介导(图3I&图3J)
4.细胞内被SnoRNA激活的PARP-1 引起的DDX21ADP核糖基化促进了细胞增殖
为了明确PARP-1和DDX21功能互作时snoRNAs的作用,作者分别用和不用RNAaseA处理MCF-7细胞,去除所有的snoRNAs后进行IP,结果发现PARP-1的确与ADP核糖基化的DDX21免疫共沉淀,肯定了PARP-1在体内是与ADP核糖基化后的DDX21的互作(图4A&4B)。用RNAaseA处理免疫沉淀复合物去除了CoIP的PARP-1和DDX21(图4A&4B上部),和PARP-1与ADP核糖基化的DDX21,这与PJ34处理的结果一致(图3F)

作者同时也探索了snoRNAs如何调节DDX21-PARP-1相互作用和ADP核糖基化,利用反义寡核苷酸(ASOs)敲低与PARP-1互作的SNORA74A以及不与它互作的SNORA15(转染这二者的ASOs 的MCF-7细胞,其表达量也减少,但是GFP靶向的ASOs却没有,如图4C)。
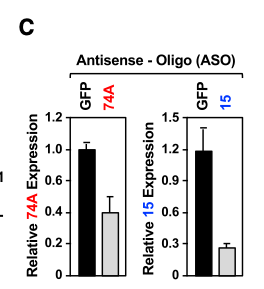
与敲低SNORA15相比,敲低SNORA74A随之引起PARP-1(图4D)和DDX21(图4E)二者ADP核糖基化、以及DDX21-PARP-1相互作用的减少(图4F),ADP核糖基化的显著降低表明SNORA74A是PARP-1主要的激活剂。
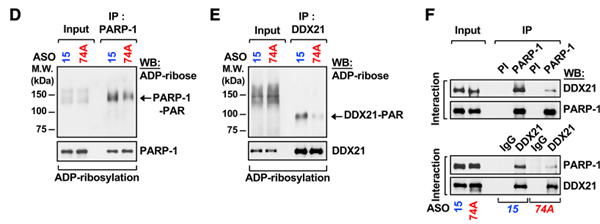
上述结果解释了snoRNAs刺激PARP-1和DDX21功能性互作,包括刺激PARP-1的催化活性造成DDX21内ADP核糖基化,促进乳腺癌细胞MCF-7而非正常细胞的增殖。
5.PAR结合通过DDX21的RNA结合序列调节PARP-1和DDX21之间的功能互作
作者接着对PARP-1与DDX21相互作用特性进行了更多的研究。他们观察到通过与PARP-1互作的snoRNAs(例如37,74a,而非不与之互作的15)活化的PARP-1促进其与DDX21牢固结合(图5A)。为了验证DDX21与PAR结合的假设,作者在有或无竞争物SCARNA2 的情况下进行DDX21-PAR结合的实验,(SCARNA2是一个通过与DDX21 C-末端RNA结合域的snoRNA),加入SCARNA2消除了在自修饰的PARP-1上DDX21与PAR相互作用(图5B),提示DDX21的RNA结合域可能调节其与PAR的结合。
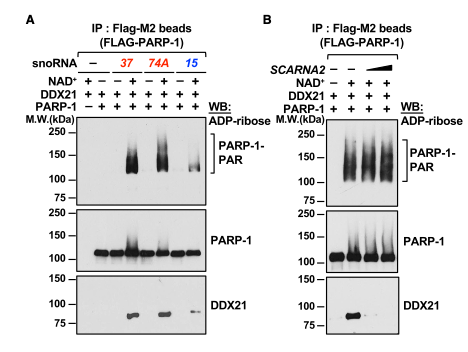
作者构建了丙氨酸替代的RNA结合域两个突变位点(K774&R775),命名为MutP,造成DDX21PAR结合缺陷(图5C),利用HEK293T细胞进行IP,结果显示,与野生型WT-DDX21相比,与FLAG-标定的MutP-DDX21结合的PARP-1大量减少(图5D上部),在MCF7细胞中结果一致(图5D下部)。
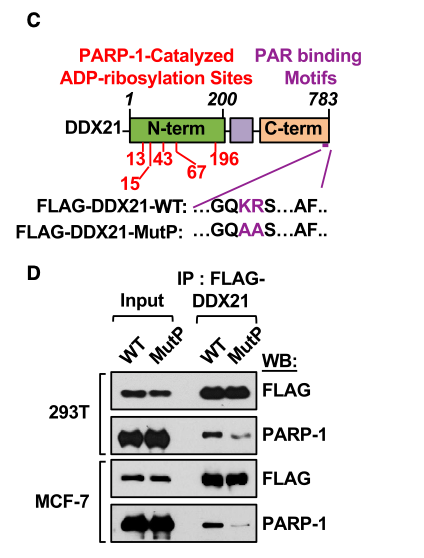
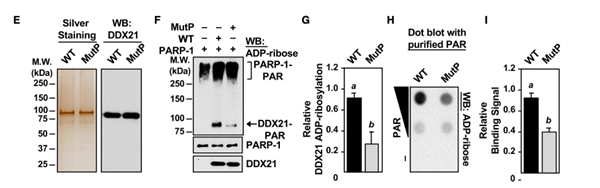
用从HEK293T细胞中纯化的WT-DDX21和MutP-DDX21(图5E)进行的ADP核糖基化检测显示,与WT-DDX21相比,MutP-DDX21 ADP核糖基化减少(图5F&5G),用纯化的PAR进行的斑点试验也显示,与WT-DDX21相比,与MutP-DDX21结合的PAR减少(图5H&5I)。
6.DDX21 的ADP核糖基化增加rRNA水平和翻译、促进乳腺癌细胞增殖
PJ34或尼拉帕利处理MCF-7后,免疫荧光染色可以看到DDX21从核仁到核浆的再分布(图6A), PARPi处理后也随之造成了核仁内定位的PARP-1减少(图6A),但不影响核仁标志物NOP58的定位(图6B),说明PARP-1的自修饰和DDX21 ADP核糖基化对于它们二者在核仁内维持的重要性。
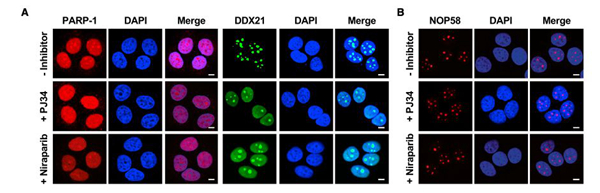
MCF-7细胞的ChIP-qPCR结果显示,DDX21在许多rDNA座位转录区域高度富集,尤其是8kb处(图6C),PJ34或尼拉帕利处理后这一结合显著减少(图6D),表明PARP-1引起的DDX21 ADP核糖基化需要DDX21在rDNA座位的占位。
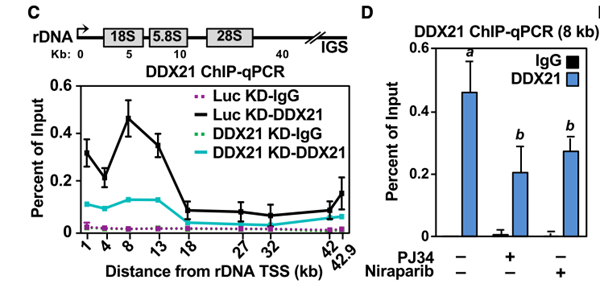
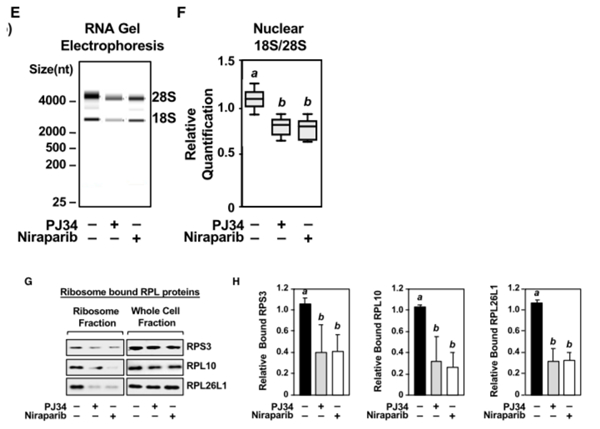
DDX21 ADP核糖基化会影响rDNA转录,PJ34或尼拉帕利抑制了PARP-1后,也造成细胞核内18S和28S rRNA水平的明显下降(图6E&6F),引起后续核糖体内结合核糖蛋白减少(图6G&6H)。
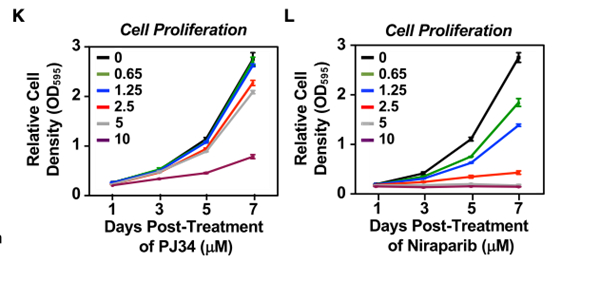
在MCF-7细胞中,不管是用PJ34或尼拉帕利抑制PARP-1(图6K&6L),还是消除DDX21,都能造成细胞增殖明显降低。
总之, SnoRNA激活的PARP-1引起的ADP核糖基化控制着DDX21核仁内定位,rDNA转录,核糖体合成、翻译和乳腺癌细胞的增殖。
7.抑制体内PARP-1可以通过调节rRNA水平、DDX21 ADP核糖基化和DDX21定位降低肿瘤细胞生长
利用TCGA数据库分析乳腺癌和正常样本中相关蛋白的表达,发掘snoRNA-PARP-1-DDX21-核糖体合成通路中潜在的生理和临床特异性,结果显示,与正常组织相比, snoRNAs、PARP-1、一套核糖体相关基因和核糖蛋白L26样-1(RPL26L1),这些蛋白在乳腺癌中显著升高(图7A-7E)。
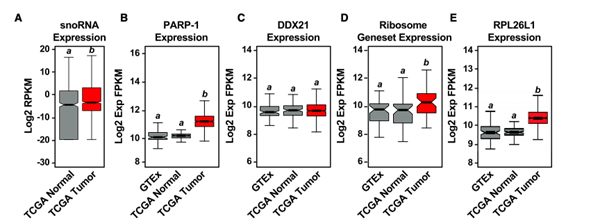
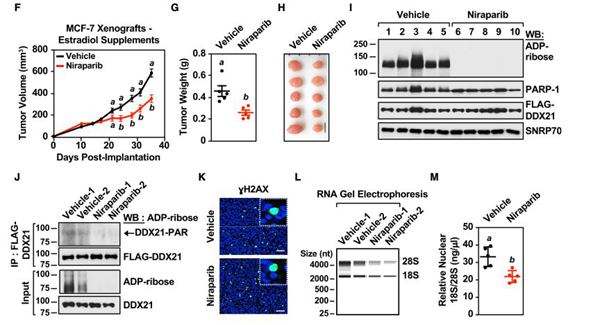
动物移植瘤模型显示,尼拉帕利抑制PARP-1催化活性后造成肿瘤生长明显降低(图7F-7H),移植瘤组织的胞核提取物的Western-blotting和IP结果显示,与对照组相比,尼拉帕利大幅度消除了PARP-1 ADP核糖基化(图7I)和随后的DDX21 ADP核糖基化(图7J), 有趣的是,尼拉帕利并不促进BRCA1/2-野生型MCF-7 中gamma H2AX 堆积 ,说明尼拉帕利这一作用与DNA损伤无关(图7K)。尼拉帕利处理的肿瘤组织中细胞核内18S和28SrRNA也明显减少(图7L&7M)。
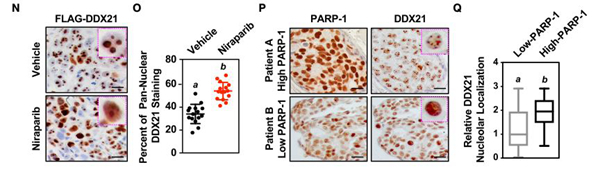
移植瘤组织免疫染色后可见(1)尼拉帕利降低肿瘤组织中DDX21在核仁内定位,增加了核周DDX21染色(图7N&7O);(2)在乳腺癌组织中,PARP-1高表达与DDX21核仁内存留密切关联(图7P&7Q)。
上述结果提示PARP-1催化活性控制着DDX21 ADP核糖基化,DDX21核仁内定位,rDNA转录和乳腺癌细胞增殖。
8.小结
这篇文章发现了乳腺癌细胞中一个依赖PARP-1核糖体合成和生长调控通路,包括(1)snoRNA结合并激活PARP-1,(2)PAR介导着PARP-1与DDX21相互作用,导致DDX21定点ADP核糖基化,(3)增强DDX21与rDNA染色质关联,(4)增加rDNA转录和细胞生长。重点是作者鉴定了snoRNA是一个不依赖DNA损伤的PARP-1催化活性激活剂,它影响着DDX21的 ADP核糖基化和核仁定位。阐明了PARP-1、核仁DDX21和RPL26L1在人乳腺癌细胞中表达的显著正相关性。这一通路为PARPi治疗缺少DNA修复缺陷的肿瘤提供另外的靶点。
9.文章总结
BRCA1/2突变肿瘤中,PARP抑制剂通过诱导细胞DNA修复缺陷,造成合成致死阻止细胞生长。这篇文章证实了在BRCA1/2正常的乳腺癌细胞中,PARPi通过参与rDNA转录和核糖体生成,控制细胞生长。PARP-1结合snoRNA,在核仁内激活PARP-1催化活性,这是不依赖DNA损伤的。活化的PARP-1利用ADP核糖基化核仁中的RNA解旋酶DDX21,引发DDX21 ADP核糖基化后促进rDNA转录,PARPi处理或者突变DDX21 的ADP核糖基化位点可以减少它在核仁内定位、rDNA转录、核糖体合成、蛋白质翻译和细胞生长。在小鼠移植瘤和人乳腺癌标本中证明了此通路这一突出的特点。PARP-1和DDX21核仁内水平升高与患者癌症结局相关,本研究为PARP抑制剂治疗缺乏DNA修复缺陷的癌症提供了有效合理的机制。
参考文献:Das-Seok kim, et al. Activation of PARP-1 by snoRNAs Controls Ribosome Biogenesis and Cell Growth via the RNA Helicase DDX21. Molecular Cell(2019). 75, 1–16, September 19.

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
