同源重组修复途径极为精确,对维持基因组的稳定性和完整性至关重要。大约有50%的卵巢癌患者存在同源重组修复缺陷(HRD)。“合成致死”的作用机制使HRD细胞对PARP抑制剂的作用更敏感。本期邀请山东大学齐鲁医院妇科张辉医生,解读2019年2月发表在ESMO Open上的一篇题目为“Controversies in oncology:are genomic tests quantifying homologous recombination repair deficiency (HRD) useful for treatment decision making?”的文章,探讨量化同源重组修复缺陷的基因检测对治疗决策的影响。

张辉副教授
副主任医师
医学博士、硕士研究生导师、留美访问学者
中国老年学和老年医学学会妇科分会青委会副主任委员
山东省抗癌协会妇科肿瘤分会青委会副主任委员
山东省医师协会妇科腹腔镜医师分会常委
中国医药教育协会疑难肿瘤专业委员会委员
中国医师协会微无创分会妇科精准诊疗专委会委员
中国妇幼保健协会妇幼微创委员会委员
《现代妇产科进展》、《中国生育健康杂志》等多家杂志的编委或审稿专家。

 00:000:00 音频
00:000:00 音频 1.DNA损伤修复与同源重组修复缺陷
DNA保护机制使基因组免受环境因素或DNA代谢过程中自发产生的损伤破坏,这个过程主要包括DNA单链和双链断裂损伤修复。
DNA单链断裂通过错配修复、碱基切除修复和核苷酸切除修复途径进行修复。
DNA双链断裂通过非同源末端连接或同源重组修复途径进行修复。其中,一些蛋白质(如γH2AX,ATM及ATR)充当双链断裂的传感器,导致信号递质蛋白(即BRCA1、BRCA2和PALB2)的激活,最终小核蛋白RAD51加载到单链DNA上,以此促进链侵入和复制叉的稳定(图1)。
对同源重组修复缺陷的肿瘤最开始的认识是携带抑癌基因BRCA1和BRCA2种系突变的肿瘤。然而,遗传学和表观遗传学事件也可导致其他同源重组修复成分的失活,导致肿瘤的散发性HRD。
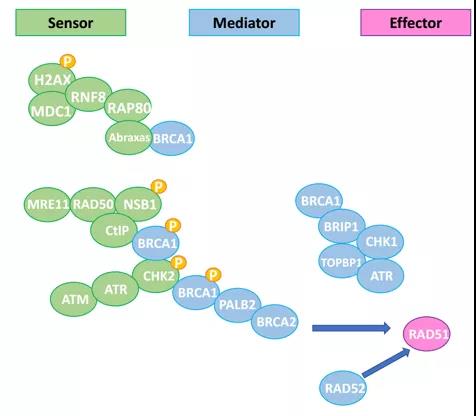
图1:同源重组通路
由于种系BRCA基因突变(gBRCAm)的存在,大约13%的卵巢癌患者携带HRD,此外还有50%的卵巢癌患者表现为无gBRCAm的情况下的HRD。由于同源重组修复是修复DNA链间交联过程中产生的DNA双链断裂所必需的,因此,HRD肿瘤对引起DNA链间交联的铂类化疗更敏感。此外,PARP抑制剂是阻断DNA单链断裂修复的新型靶向药物,导致DNA双链断裂大量积累,而同源重组修复缺陷的细胞无法修复,BRCA突变细胞对PARP抑制剂的作用更敏感。PARP抑制剂还能将PARP捕获到DNA上,造成这些细胞有毒性的复制压力。
2.量化HRD的基因组检测方法
目前已有三种PARP抑制剂(尼拉帕利、奥拉帕利、芦卡帕利)获批用于铂敏感复发卵巢癌的维持治疗。具有同源重组修复途径的改变和BRCA突变肿瘤分子特征(所谓的“BRCAness”表型)的野生型患者也可能从PARP抑制剂的治疗中获益,临床主要的挑战是如何准确鉴定出这类患者。
目前有不同的方法来鉴定存在同源重组修复缺陷的BRCA野生型肿瘤患者,具体方法有:
(1)记录大量基因组异常,即所谓的“基因组瘢痕”
(2)突变信号分析
(3)用DNA测序panel识别同源重组修复基因的点突变
GenomicScars检测的两种方法:
Myriad“myChoice HRD”测定法基于三项Genomic Scars值计算评分:
杂合性缺失(LOH)、
端粒等位基因不平衡、
大片段迁移
若HRD score≥42或BRCA1/2突变型,则HRD阳性;
若HRD score<42且BRCA1/2野生型,则HRD阴性。
“FoundationFocus CDx BRCA LOH”检测法包括两个主要因素:
肿瘤BRCA突变状态、
基因组LOH高低
高LOH:比例≥16%;低LOH:比例<16%。
HRD阴性定义:BRCA野生型同时LOH值低。
另外,突变特征(signature)是每个突变过程留在肿瘤基因组上的特征模式。例如,HRD与Alexandrov等人描述的“signature 3”有关。“signature 3”也能准确地将具有已知功能意义的BRCA1 / 2错义突变分类,并且与启动子甲基化沉默的RAD51C和BRCA1相关。
那么,利用“基因组瘢痕”来量化HRD,及其影响治疗决策的临床证据是什么?主要问题是:“基因组瘢痕”是否是BRCA基因突变之外预测对铂类或PARP抑制剂反应的生物标志物?
3.HRD状态对晚期卵巢癌PARP抑制剂维持治疗疗效的预测作用
如Table 1所示,NOVA研究证明了尼拉帕利在所有铂敏感复发卵巢癌维持治疗中的疗效——BRCA突变或HRD阳性的患者有显著获益,BRCA野生型且HRD阴性患者的PFS也有改善,尽管这部分患者与BRCA突变或HRD阳性患者相比,获益的程度较小。ARIEL2及ARIEL3研究也证明了不同基因状态的患者在芦卡帕利维持治疗中的获益程度。

从这些研究中可以看出,在铂敏感人群中,HRD-基因组瘢痕的检测提供了有关临床获益程度的信息,患者铂敏感治疗后对parp抑制剂维持治疗有很高的反应率,在HRD阳性或BRCA突变的患者中获益的程度更高。最重要的是, HRD检测是否可用于筛选可能从PARP抑制剂治疗中获益的铂抵抗患者,或筛选对PARP抑制剂/铂类治疗有较长应答的患者,尚需进一步验证。
专家点评
可以确定的是,与卵巢癌中HRR缺陷相关的基因瘢痕可以识别铂敏感复发后从PARP抑制剂维持治疗中得到最大获益的患者。
目前基因组瘢痕检测的局限是不可能捕获到肿瘤进化的全过程。作为替代方案,通过检测拷贝数变异、甲基化或基因表达谱,来鉴定与BRCA突变有相似生物学行为的肿瘤。这种方法或许可行,但前瞻性验证的缺乏和大规模检测的可行性似乎是目前临床应用的主要问题。
未来需要更多研究来确认临床上进行的HRD检测对预后的预测作用,以及是否有助于鉴别可能从PARP抑制剂中获益的铂抵抗患者,以进一步明确卵巢癌的靶向治疗策略。

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
