基因组不稳定是癌症的特征之一,通常是肿瘤细胞DNA损伤修复能力改变的结果。2009年,PARPi的首次人体临床试验证明了抑制PARP1(DNA损伤的关键感受器)与BRCA1/2缺失之间的合成致死效应。在过去的十年中,人们对PARPi作用机制及耐药机制了解得越来越深入。因此,本期邀请北京协和医院肿瘤妇科中心俞梅教授,解读2019年6月20号发表在Annals of Oncology上的一篇题目为“A decade of clinical development of PARP inhibitors in perspective”的综述,总结十年来PARPi的临床发展,讨论利用PARPi扩大精准医疗的机会,识别能从PARPi中获益的更广泛人群。

俞梅教授
副主任医师
医学博士
中国医学科学院北京协和医院肿瘤妇科中心副教授
北京医学奖励基金会妇科肿瘤专委会秘书长
北京医学会妇科肿瘤分会秘书
中华医学会计划生育学会遗传优生学组委员

 00:000:00 音频
00:000:00 音频 1.转化研究的快车道: 启动PARPi临床开发
2005年,两项开创性的研究表明,缺乏BRCA1/2的肿瘤细胞对PARP家族的小分子抑制剂具有选择性敏感性。PARP1主要参与DNA单链断裂(SSBs)的修复,是PARPi的主要靶点。单独的抑制PARP1并不会导致细胞死亡,因为PARPi引起的DNA损伤可以通过其他途径去修复,例如同源重组修复(HR)。BRCA1/2是HR通路上的关键蛋白,修复DNA双链断裂。在肿瘤存在BRCA1/2突变,导致同源重组修复缺陷(HRD)的情况下,PARPi引起的DNA损伤无法修复,从而达到合成致死的效应。降低PARP1水平也可以导致BRCA1/2缺陷细胞的存活率显著降低。
PARPi最初是作为放疗和化疗增敏药物用于癌症治疗,但多项临床前研究支持了PARPi作为治疗BRCA1/2缺陷肿瘤的药物的发展。临床前研究向临床研究的快速转化,推动了PARPi在不同瘤种中的发展。
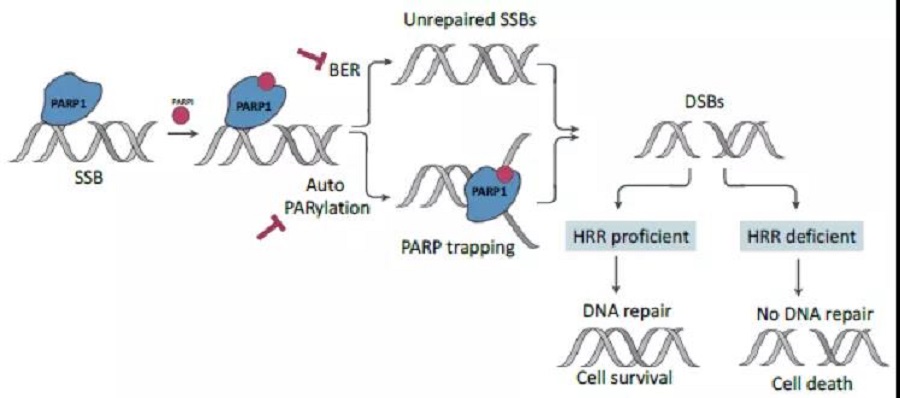
图一 PARPi作用机制
PARPi在卵巢癌中的发展
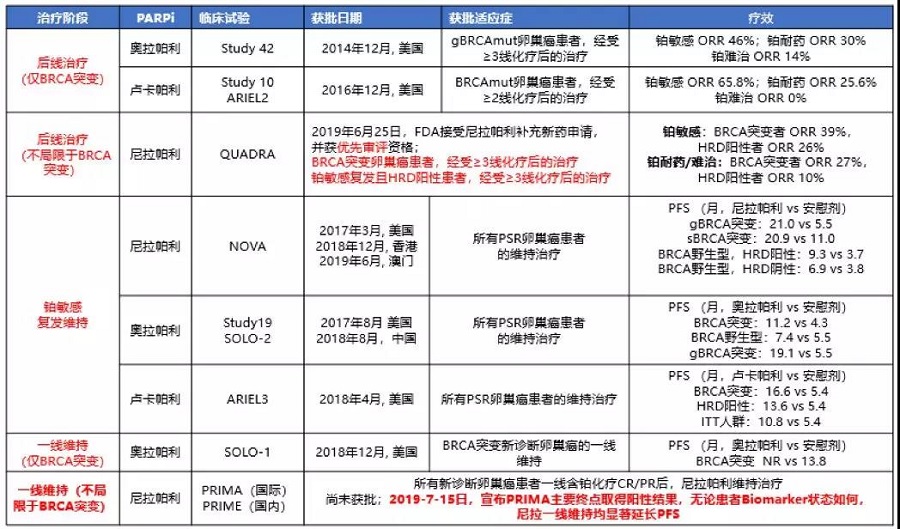
PARPi在乳腺癌中的发展

除此之外,基于肿瘤进化相关的耐药机制较少出现在疾病早期阶段的假设,PARPi在乳腺癌早期阶段也在开展临床试验,包括用于新辅助。
PARPi在其他HRD实体瘤中的发展
最近一项研究分析发现,除卵巢癌和乳腺癌外,前列腺癌、皮肤癌(非黑色素瘤)、子宫内膜癌、胰腺癌及胆道癌中BRCA1/2突变发生率>5%。除BRCA突变外,若其他参与DNA损伤修复(DDR)的基因(如PALB2, ATM, FANCA)突变,理论上PARPi也能起效。目前开展的临床试验主要集中在前列腺癌和胰腺癌,且几种PARPi均有初步的结果报道,更多试验正在进行中。
2.PARPi预测性生物标记物的发展
在PARPi早期开发阶段,主要集中在gBRCA突变检测,后来发展为利用NGS多基因panel检测一些临床医生感兴趣的同源重组修复(HRR)基因突变情况。除此之外,检测HRD造成的表现,即基因组疤痕(Genomic Scar)也是生物标记物探索的研究热点。目前通过基因组疤痕检测肿瘤HRD技术比较成熟的有Foundation Medicine的“FoundationFocus CDx BRCA LOH”检测以及Myriad公司的“myChoice HRD test”。Foundation Medicine主要检测基因组杂合性缺失(LOH);卢卡帕利ARIEL3研究中将LOH≥16%定义为HRD阳性。Myriad’s myChoice HRD检测通过综合LOH、端粒等位基因不平衡(TAI)及大片段迁移(LST)进行评分,将分值≥42或BRCA突变定义为HRD阳性,分值<42且BRCA野生型定义为HRD阴性;尼拉帕利NOVA研究中HRD检测即采用Myriad方法。
另一种方法是评估关键DNA修复蛋白的表达,如通过免疫组化检测的ATM蛋白可以体现ATM基因状态,蛋白质功能测定可以直接告知肿瘤细胞修复损伤的能力。
3.PARPi耐药机制
PARPi获得性耐药机制已经在多项临床前和临床研究中被描述,主要分为三大类(见图2),多种耐药机制可能共存。
首先,不同机制的HR功能恢复可能造成PARPi耐药。最常见的情况是HR基因(BRCA1/2, PALB2, RAD51C/D等)移码突变或无义突变的肿瘤发生二次突变。此外,BRCA1亚等效基因变体的功能表达、BRCA1启动子去甲基化均与PARPi耐药的发生相关。
其次,复制叉保护是PARPi另一耐药机制,通常与细胞周期进程的减慢相结合。BRCA1/2和PARP1等在保护停滞的复制叉方面发挥重要作用,这是使得DNA损伤后的复制叉修复成为可能的关键步骤。当BRCA1/2及PARP蛋白缺乏时,复制叉被广泛降解,导致肿瘤细胞死亡。因此,如果有其他途径保护稳定的复制叉,则可能造成PARPi耐药。
此外,PARP1 DNA结合域的突变代表了其他可能的耐药机制。同样地,增加PARP1 聚腺苷二磷酸核糖脱羟基化(PAR化)、减少PARP捕获也能导致耐药。除了重组DNA损伤应答的机制外,ATP结合盒(ABC)转运体(如P-糖蛋白外排泵)的高表达也可以降低PARPi疗效。
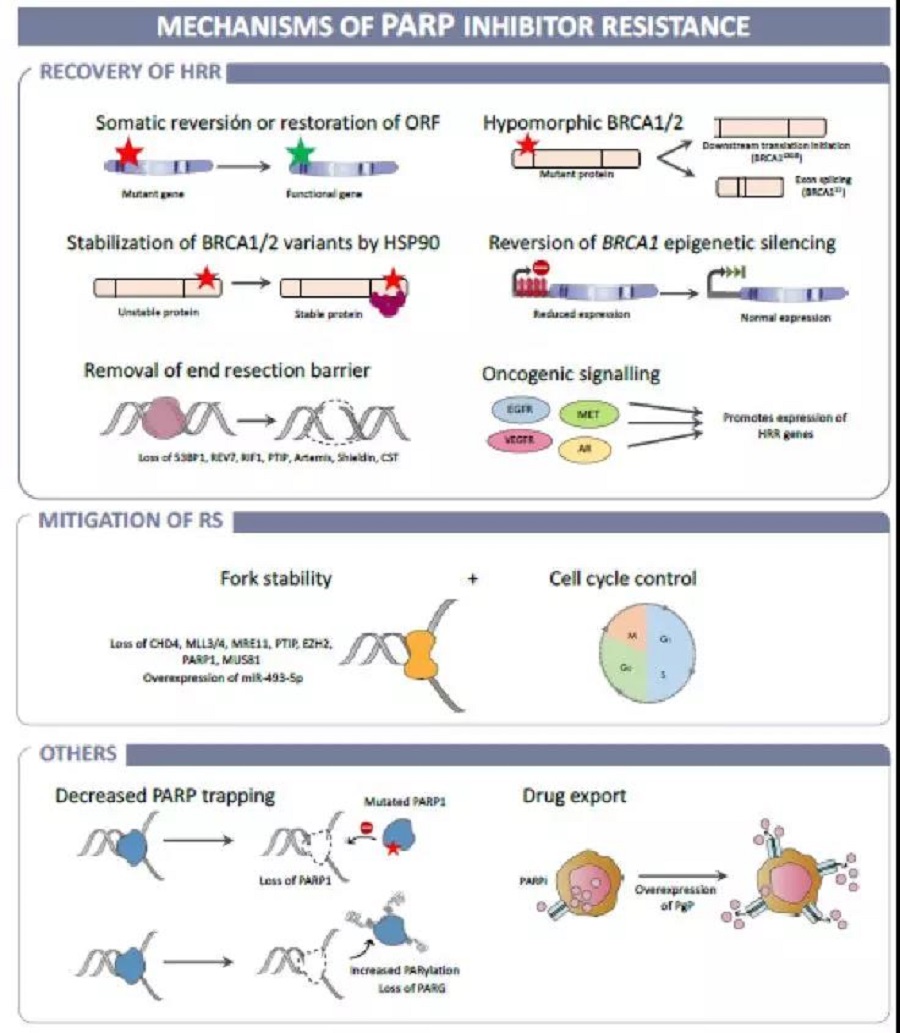
图2 PARPi耐药机制
4.结束语及未来发展方向
PARPi在过去10年来的成功开发,已经为一部分卵巢癌和乳腺癌提供了有效治疗方案,并有望在不久的将来扩展到其他生物标志物驱动的肿瘤适应症。在未来的几年内,PARPi的应用可能会进一步扩大。我们需要更好地理解除BRCA1/2突变以外,什么样的基因、蛋白或功能变化使得不同肿瘤对PARPi敏感;其次,通过开发更精准的分析方法,利用不同的预测性生物标记物对敏感患者进行分层。促进基因组学在常规临床实践中的应用,也将导致更广泛的患者接受检测,更多的患者从PARPi治疗中获益。合理的PARPi与其他药物的联合有助于拓展PARPi获益人群(见图3)。利用抗血管生成、组织缺氧、DNA损伤、免疫检查点抑制剂解除免疫逃逸、激素受体驱动等多重途径,希望发挥协同抗肿瘤疗效。优化PARPi与其他药物联合应用时各个药物的剂量、给药时机是关键。
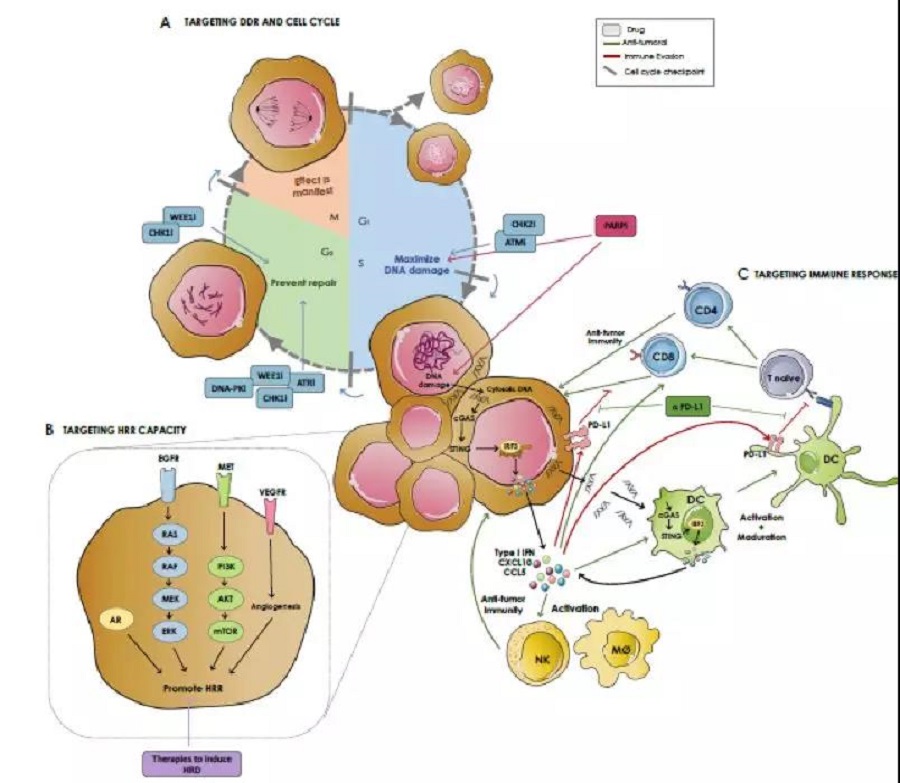
图3 PARPi与其他药物的联合方向

扫二维码
关注OC资讯

OC资讯小助手
为您提供更多帮助
