各位妇科同仁,大家好!我是国际和平妇幼保健院的王玉东医生。近年来研究认为,DNA损伤应答(DNA damage response,DDR)系统对肿瘤发生,发展及治疗具有重要作用,其中基于合成致死(synthetic lethality)原理研发的PARP抑制剂就是其中的代表之一。如今,PARP抑制剂在不同癌种特别是妇科肿瘤卵巢癌领域有很大突破。今天想和大家分享2019年1月发表在JCO的综述,文章对PARP抑制剂以及作用DDR通路的抗肿瘤药物进展进行了总结。

王玉东教授
上海交通大学附属国际和平妇幼保健院(中国福利会国际和平妇幼保健院)
从事妇科良性、恶性肿瘤微创手术及肿瘤内分泌治疗
2013年上海市卫生系统优秀学科带头人
中国优生科学协会肿瘤生殖分会主委
中国医师协会微无创专业委员会妇科肿瘤分会副主委
中国医师协会微无创专业委员会智能医学分会副主委
中国医师协会整合医学专业委员会盆底整合分会副主委
上海市医学会妇产科分会副主委
中国妇幼保健协会青年分会副主委
中国非公协妇产科分会副主委
中国中西医结合妇科学会常委
中国妇幼保健协会微创分会常委
中国医师协会内镜医师分会委员
中国医师协会妇产科分会委员
上海市医学会妇科肿瘤学会委员
医学参考报妇产科副主编
中国实用妇科与产科杂志编委
中国妇产科临床杂志编委
1.背景介绍
基因组不稳定是肿瘤特征之一。这种不稳定性主要来自肿瘤细胞中癌症基因导致的复制压力。这些复制压力可以绕过保护DNA保真度的细胞周期检查点从而导致更多变异。
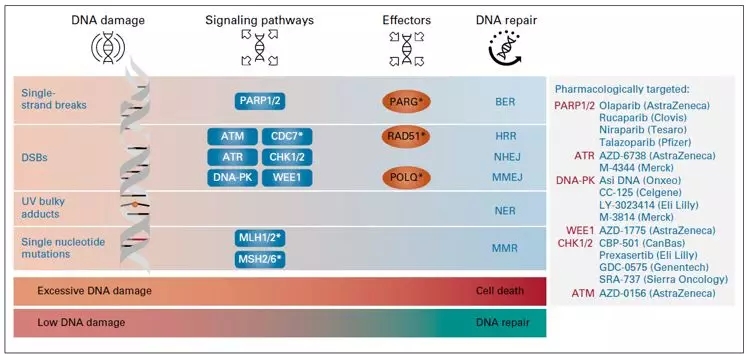
除了复制叉压力,DNA损伤可以来自各种外源(如酶反应,化学修饰,复制错误)或内源因素(如紫外线,电离辐射,化学物质)。DNA损伤应答(DDR)系统由一个蛋白质网络构成,主要用于感知,传递信号,和/或修复DNA损伤。DDR通过DNA修复协调细胞周期进展,将传递给子代细胞的DNA损伤降至最低。如下图所示,参与DNA损伤到细胞周期检查点和DNA修复通路信号传递的关键蛋白包括ATM蛋白激酶,ATR激酶,DNA依赖性蛋白激酶(DNA-PK),DNA-PKcs激酶。参与应答通路的修复机制包括(1)修复单链DNA的碱基切除修复(2)修复DNA附加物的核苷酸切除修复(3)错配修复主要针对错配的碱基(4)修复双链DNA损伤和链间/链内交联的同源重组修复(HRR)(5)通过末端重连的同源末端连接NHEJ(6)选择性非同源末端连接修复用于DNA双链修复,但不常用(图1)。如果DNA损伤太严重或不可修复,DDR检查点会引发细胞凋亡。反应路径反应过弱或过强也会导致不可修复的损伤和细胞死亡。PARP抑制剂就是利用HRR缺陷开发的。通过DDR抑制从而影响复制压力的抗癌靶点也在开发中。大约有450个基因编码的蛋白质参与了DDR,本文主要介绍了一些PARP抑制剂以及一些重要的DDR靶点。
2.PARP抑制剂作用机制
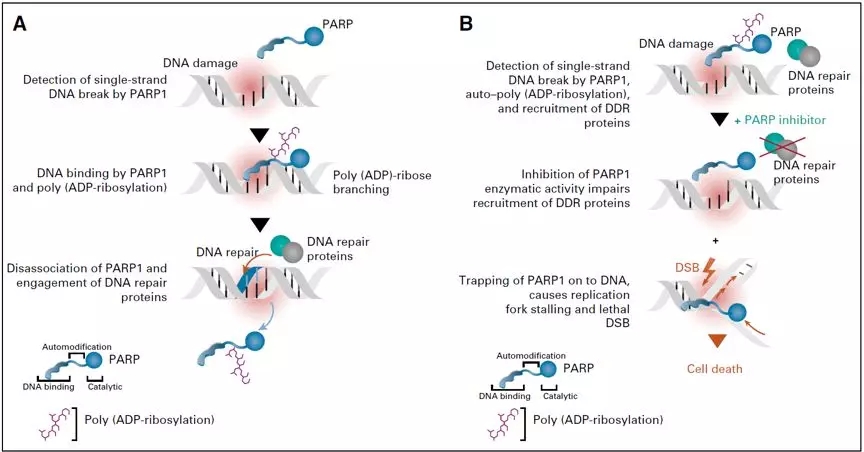
自PARP1/2发现以来,与PARP1催化结构域相似的17个PARP酶家族成员已被确认。PARP抑制剂不仅抑制PARP酶活性,而且还通过捕获DNA链上的 PARP1发挥作用。目前缺乏临床头对头比较,但体外数据显示,各种PARP抑制剂的肿瘤致死能力更多与PARP捕获相关,这种捕获作用导致复制叉的停滞和后续的双链DNA损伤(图A1)。

3.PARPi在卵巢癌适应症的相关数据
多达50%的高级别浆液性卵巢癌携带HRR相关的遗传或表观遗传缺陷 (导致同源重组修复缺陷,HRD)。BRCA1和BRCA2是最常被提及的2个突变基因,其他同源重组基因,如RAD51C,RAD51D, ATM, BARD1, PALB2, BRIP1约占10%的HRD。另外HRD与铂敏感之间的相关性很高,这也能解释为什么铂敏感已经成为选择PARP抑制剂治疗的临床指标。
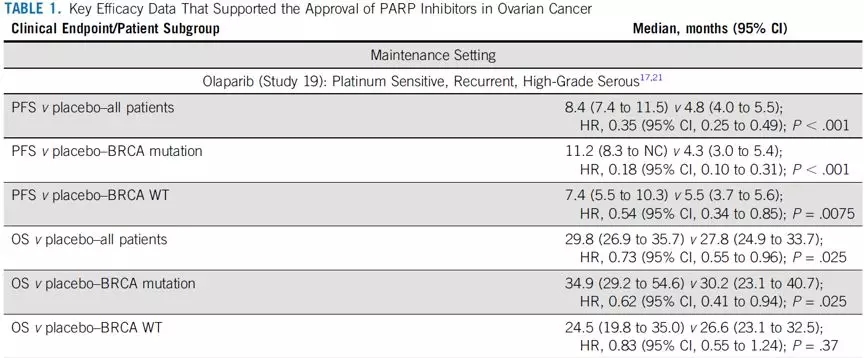
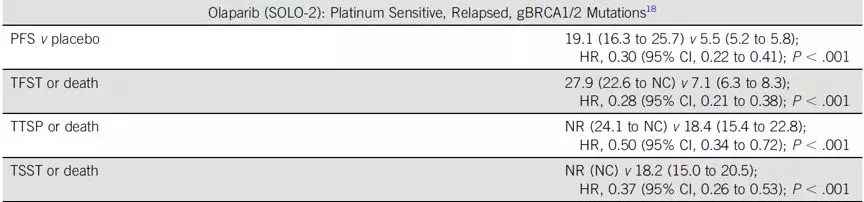
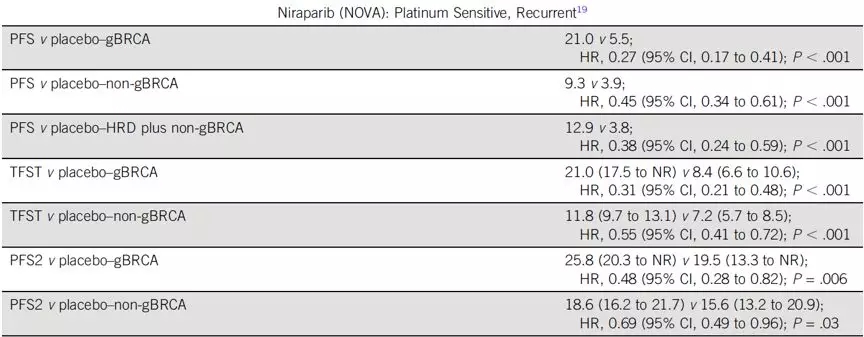
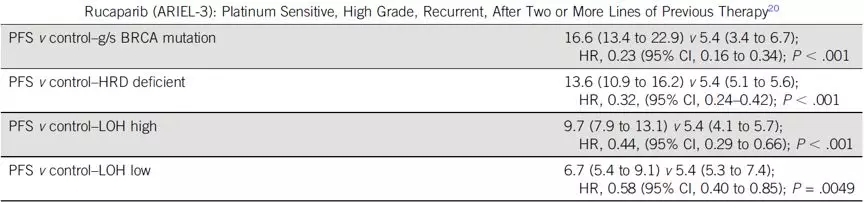
尼拉帕利,奥拉帕利和Rucaparib均被批准用于铂敏感复发(PSR)卵巢癌的维持治疗。对于g/sBRCA突变的PSR患者,接受PARPi维持能显著延长PFS(关键性三期研究中PARPi对比安慰剂PFS范围:16.6-21个月vs 5.4-5.5个月)。SOLO2仅纳入了gBRCA突变患者,但尼拉帕利NOVA,Rucaparib ARIEL-3,以及奥拉帕利II期study19证明PARPi对于BRCA野生型患者同样获益,不同分子亚组HR值在0.38-0.58之间。Rucaparib获批用于既往接受≥2线的g/sBRCA突变的单药治疗,奥拉帕利获批用于既往接受≥3线gBRCA突变的单药治疗(表1)。SOLO1数据显示对于g/sBRCA突变的初治卵巢癌患者,奥拉帕利能显著延长PFS,在36个月随访时,奥拉帕利组中位PFS还未达到,安慰剂组为13.8个月,HR=0.30(表1未列出)。

4.PARP抑制剂的未来
1. 筛选合适的患者
BRCA突变的患者在临床已经能较准确的筛选出来,但这部分患者群较小。
与HRD表型相关的基因伤疤和突变标签检测能找到更广泛的DDR靶点获益人群。HRD相关的分子标签和相应的生信分析尚未达到临床应用。伴随诊断,如MyChoice HRD检测和Foundation杂合性缺失检测能帮助找到更多PARPi获益人群,但不能确定非获益人群。
铂敏感已经被证明是HRD的替代标记物,但铂敏感和PARPi应答也不是完全一致,提示了内在DNA修复机制的差异。遗传性BRIP1、BARD1、CHEK2、RAD51C和ATM基因突变带来的风险都可能增加肿瘤风险,但这些基因导致HRD的程度尚不清楚。
另一个可能的检测方式是确定non-BRCA1/2 HRR蛋白质,如通过免疫荧光检测核RAD51转化灶。RAD51在HRR中至关重要,RAD51同HRD,化疗和PARP抑制剂的治疗反应相关。最近,这种分析已经可以在石蜡包埋组织块中进行,未来可能应用到临床帮助确定PARPi获益的HRD人群
谈到病人如何选择,治疗前了解肿瘤先天基因突变情况,将这些信息和评估PARPi敏感度的生信分析结合,能帮助确定患者的个体化治疗方案。
2. 了解耐药
虽然基础研究显示了几种PARPi获得性耐药的机制,但目前临床数据仅显示HRR恢复和BRCA1亚等位基因形成是相关机制。通过BRCA逆转突变能重建开放阅读框和BRCA1 BRCA2、PALB2或RAD51C(铂耐药相关)功能。值得注意的是,报道的BRCA1逆转突变的患者表现出MMEJ信号,提示POLQ(MMEJ必需)会驱动耐药。
HRR基因的表观遗传变化也被证明和PARPi的敏感性和耐药相关。如BRCA1基因的甲基化和RAD51C赋予PARP抑制剂敏感性,随后的去甲基化与蛋白质再表达以及耐药相关。
根据胚系或其他突变或其他因素,如不同的肿瘤发生或前序治疗,在别的肿瘤可能会出现不同的耐药机制。这些突变可能包括PARP1表达缺失;通过53BP1,MAD2L2/Rev7或Shieldin复合物缺失破坏末端切除规律;通过CHD4缺失激活DNA跨损伤合成,从而允许低效率HRR的进行。
稳定复制叉,上调药物外排基因相关PgP转运体也被认为是新的耐药途径
5.从PARP到DDR
1. 基于合成致死机制的开发
基于合成致死机制的抗肿瘤探索并未停止,如MMEJ通路上,POLQ是必需的。在HRR缺陷细胞中,POLQ表达上调,MMEJ作为替补发挥修复作用。在HRR缺陷细胞中引入POLQ抑制剂能产生合成致死的效果。也有研究显示在前列腺癌和慢性淋巴细胞白血病中,RNASEH2B确实能增加PARP捕获能力,也能作为一种治疗靶点
2. 未来的DDR治疗策略
在PARPi之后,DDR抑制剂主要在两个方向进行研发:DNA损伤信号和DNA修复。ATM和DNA-PKs被DSB招募并分别执行检查点信号和DNA修复;ATR能被复制压力激活,从而稳定和重启复制叉。CHK1和CHK2是在ATR和ATM下游起作用的激酶;WEE1是一种典型的检查点激酶,对有丝分裂进行负调节。RAD51和POLQ分别直接参与双链DNA修复的同源重组修复和MMEJ。PARG是一种酶,参与分解PARP酶家族(图3)。
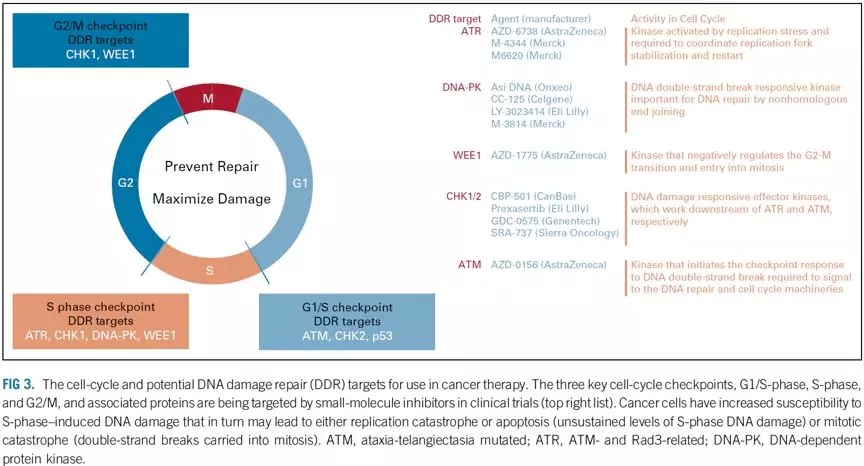
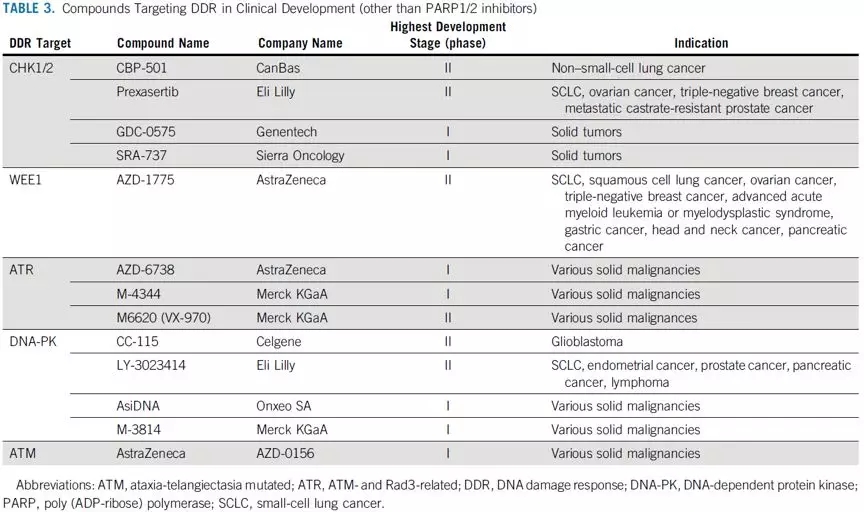
其中一些分子已经在HRD肿瘤或与化疗和靶向药物联合使用中进入临床开发阶段(表3)。总的来看,若作为单药治疗,DDR抑制剂的疗效将取决于肿瘤DDR相关的特定遗传背景,如在ATM缺陷肿瘤中应用ATR抑制,在细胞周期蛋白E(cyclin E)或MYC扩增的肿瘤中应用WEE1;在HRD或NHEJD肿瘤中应用POLQ抑制剂。通过CHK1/2和WEE1抑制剂使G2/M检查点沉默,目前正在联合化疗进行临床试验。联合治疗的效果主要取决于联合用药的时机,给药方案,降低毒性并维持治疗效果。
需注意的是,DDR通路虽然有很多新的治疗靶点,但治疗的窗口期和以上这些靶点的biomarker检测手段依然有限。
3. DDR靶点联合治疗机遇
联合的主要方向包括*
DDR抑制剂间联合:如奥拉帕利联合ATR抑制剂(NCT02264678)
DDR抑制剂同抗血管生成药物联合:如尼拉帕利联合贝伐单抗的AVANOVA研究(NCT02354131),奥拉帕利联合西地尼布的ICON9(NCT03278717)
DDR抑制剂联合免疫治疗:如尼拉帕利联合免疫的TOPACIO(NCT02657889)和FIRST研究(NCT03602859)
*可从原文找到更多研究介绍
6.DDR抑制剂面临的挑战
了解不同PARP抑制剂作用机理的差异以及特定BRCA突变对疗效的影响对未来DDR抑制剂开发同样重要
耐药同样是DDR抑制剂开发要面临的问题,联合治疗可能是一个选择。最终的目标是希望找到对特定人群或特定耐药有效的DDR靶点
很重要的问题在于如何从基因和表观遗传水平确定HRD?如何将HRD biomarker同PARP抑制剂敏感性关联?肿瘤分子异质性如何影响治疗方案和耐药?
DDR抑制剂和化疗或其他药物治疗的顺序还不清楚,仍需更多探索。
专家点评
PARP抑制剂已被批准用于所有铂敏感复发卵巢癌的维持治疗。现有检测手段有限,铂敏感也可以作为PARP抑制剂敏感性的替代指标。
针对DDR通路的靶点研究很多,也很值得期待。精准医疗的大方向下,作为临床医生,我们应该多关注一些肿瘤研究的进展,包括基础研究,对患者的基因突变有更深入的认识,才能帮助我们选择更合理的治疗手段,从而帮助患者从这些新的药物中最大获益。

扫二维码
关注OC资讯
