众所周知,PARP抑制剂通过对PARP酶的抑制和捕获作用,使存在同源重组修复缺陷的肿瘤细胞凋亡。在铂敏感高级别浆液性卵巢癌和gBRCA突变的晚期乳腺癌患者中都有确切的疗效。免疫检查点抑制剂靶向抑制免疫受体,通过激活抗肿瘤的免疫反应,达到持久的应答。目前已应用于多种癌症的治疗,包括黑色素瘤,非小细胞肺癌,肾癌,子宫内膜癌等。最新有研究显示,PARP抑制剂拥有调节肿瘤免疫微环境的潜力。然而,PARP抑制剂和免疫抑制剂联合治疗的潜在获益和相应的作用机制尚未有系统性的研究。 沈源明 教授 浙江大学博士,德国吕贝克大学医学博士
今天我们特邀浙江大学附属妇产科医院沈源明医生与大家一起分享发表在Science Reports上的一项临床前研究。这项研究评估了尼拉帕利治疗对肿瘤微环境的影响,同时评价了尼拉帕利联合PD-1抗体治疗在BRCA突变和非突变的肿瘤模型中的疗效。
浙江大学附属妇产科医院副主任医师,硕士生导师
中华医学会妇科肿瘤分会青委副主任委员
中国抗癌协会妇科肿瘤专委会委员
 00:000:00 音频
00:000:00 音频
Niraparib治疗可诱导具有免疫原性的BRCA突变和非突变肿瘤模型中I型和II型干扰素通路的激活
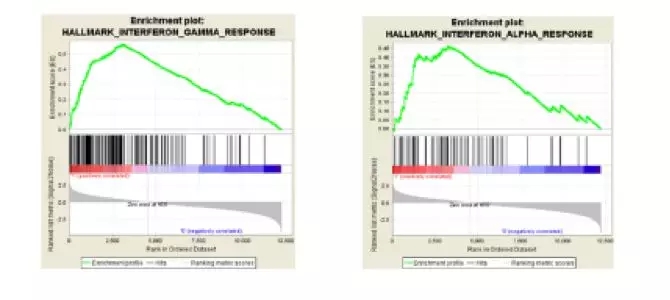
在非BRCA突变的PDX肿瘤模型中干扰素γ和干扰素α的基因集富集分析
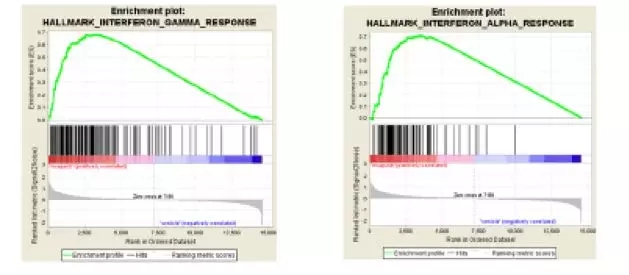
在BRCA突变的PDX肿瘤模型中干扰素γ和干扰素α的基因集富集分析
为了探究niraparib的潜在免疫调节作用及其分子基础,研究者采用功能基因组学方法分析了niraparib治疗后肿瘤内基因表达的变化。结果显示,在BRCA突变和非突变的两种肿瘤模型中,niraparib治疗均显著增加了I型和II型干扰素通路相关基因的表达。
Niraparib在 BRCA突变和非突变的肿瘤模型中促进免疫细胞的浸润
由于干扰素信号通路的激活在调节肿瘤微环境中起着重要的作用,接下来,研究者评估了niraparib治疗敏感的肿瘤微环境中免疫细胞的组成。在BRCA非突变的尼拉帕利敏感性PDX模型中,免疫细胞表面标志物的免疫组织化学染色显示,niraparib治疗后CD4+和CD8+细胞数量显著增加。同时观察FoxP3+细胞(调节性T细胞)诱导率的变化趋势。提示尼拉帕利治疗可促进包括调节性T细胞在内的整体免疫细胞浸润。进一步评价尼拉帕利在BRCA突变PDX模型中对肿瘤免疫微环境的影响。多色流式细胞仪分析显示, niraparib治疗后,CD8+ T细胞的增殖增加。相比之下,CD4+和FoxP3的增加不明显。提示在BRCA突变的肿瘤模型中,CD8+ T细胞的增殖具有特异性。综上所述,niraparib通过增加肿瘤内免疫细胞数量来调节肿瘤免疫微环境。
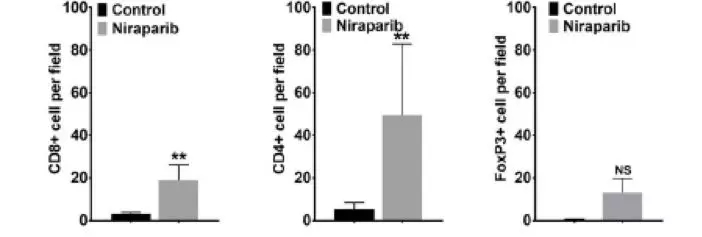
在非BRCA突变肿瘤模型中使用尼拉帕利治疗后免疫细胞数量增加
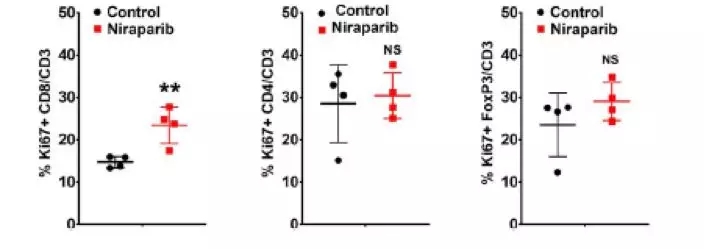
在BRCA突变肿瘤模型中使用尼拉帕利治疗后免疫细胞数量增加
Niraparib在免疫缺陷的 BRCA突变和非突变的肿瘤模型中激活干扰素通路
因为肿瘤细胞和免疫细胞都可能参与干扰素通路的激活,接下来,研究者分析了免疫缺陷的niraparib敏感的BRCA突变PDX模型中肿瘤特异性转录组的变化,以此来确定niraparib诱导的干扰素通路激活的起源。对差异表达基因的通路富集分析显示在BRCA突变的PDX模型中I型和II型干扰素活性增加。此外对8例尼拉帕利敏感性乳腺癌、肺癌和膀胱癌肿瘤组织接种的免疫缺陷小鼠的PDX模型进行差异表达基因的通路富集分析也显示,在免疫缺陷小鼠PDX模型中,niraparib治疗后,I型和II型干扰素通路活性增加。这些结果表明,niraparib诱导的I型干扰素通路的激活可能不需要一个完整的自身免疫系统存在。由于免疫缺陷模型可能仍然含有残留的小鼠免疫系统,在体外培养的BRCA突变肿瘤细胞株中检测了niraparib治疗后I型干扰素RNA的表达,结果显示,尼拉帕利治疗24小时和48小时后BRCA突变的乳腺癌细胞中干扰素β的表达增加了3-4倍。在BRCA2非突变的细胞株中,尼拉帕利也增加了干扰素β的表达,同时还可以检测到干扰素α的表达。鉴于肿瘤细胞是体外培养系统中唯一存在的细胞,这些结果清楚地表明,niraparib在肿瘤内部诱导了I型干扰素基因的表达。
由于STING通路已经被证实是肿瘤细胞内在诱导DNA损伤相关炎症免疫反应的调节机制,下一步研究者在BRCA突变的细胞株中检测STING通路的激活情况。结果显示,BRCA突变的细胞株在接受尼拉帕利治疗48小时后STING通路相关基因表达升高,同时观察到STING磷酸化水平的增加,这是STING下游信号传导和免疫激活的一个关键事件。在BRCA非突变的细胞株中也观察到了相同的现象。除此之外,最近发现的与肿瘤细胞STING通路激活相关的一种现象,微核形成,在BRCA突变和非突变的细胞株中均可观察到。这些结果表明,niraparib可能通过激活肿瘤细胞中的STING通路,诱导干扰素的表达。
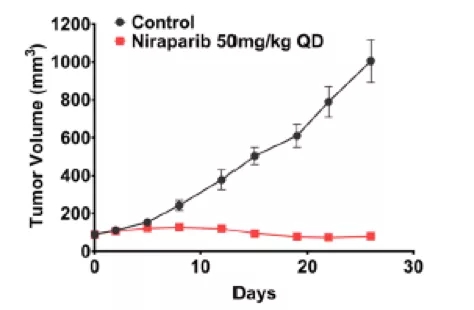
免疫缺陷的BRCA突变PDX模型中Niraparib治疗组和对照组肿瘤体积变化
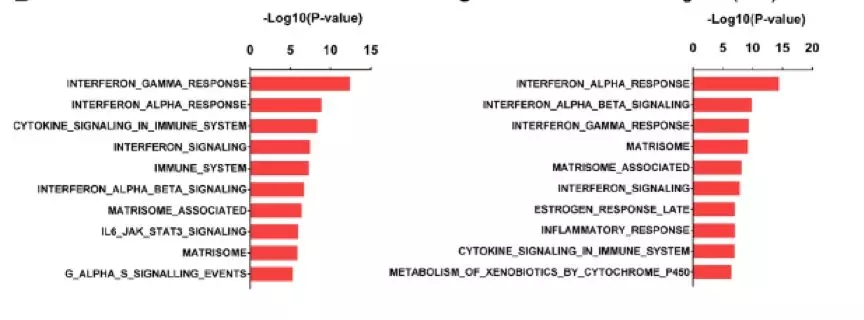
免疫缺陷的PDX模型中的差异基因的通路富集分析
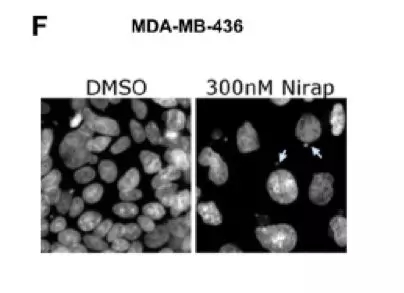
BRCA突变的乳腺癌细胞株中观察到的微核形成
Niraparib和抗PD-1抗体联合治疗在BRCA突变的PDX模型中具有持久的抗肿瘤活性
鉴于niraparib调节肿瘤免疫微环境,为免疫检查点治疗提供良好的条件,接下来,研究评估了niraparib联合抗pd -1抗体治疗在PDX模型中的疗效。在BRCA突变三阴性乳腺癌PDX模型中,给与niraparib(每日35 mg/kg, 服用5天,停2天)和pembrolizumab (200 mg,每日两次,每周一次)联合使用显示出明显更好的抗肿瘤效果,在治疗4周后,尼拉帕利单药治疗肿瘤抑制率63%,帕姆单抗单药治疗肿瘤抑制率41%,而联合治疗肿瘤抑制率达到75%。在BRCA突变的转移性浆液性卵巢癌的PDX模型中评估联合治疗的疗效,在这个模型中观察到niraparib单药治疗疗效与剂量相关,当使用50 mg/kg/日剂量治疗时肿瘤完全消退,而在使用30 mg/kg/日的剂量治疗时,肿瘤生长抑制率为64%。PD-1抑制剂单药治疗的TGI是65%。与单药治疗相比,非最大剂量(30 mg/kg)的niraparib和抗pd -1抗体联合使用肿瘤反应更明显,达到了完全的消退。在本模型中,当最大剂量niraparib (50 mg/kg)联合抗pd -1治疗时,也观察到了联合治疗的获益,因为联合治疗比最大剂量niraparib单药治疗更快达到肿瘤完全消退。为了评估疗效的持久性,在治疗终止后继续观察5周,肿瘤恢复生长的概率在联合治疗组明显低于单药组,联合治疗的两个PDX模型肿瘤均未出现任何重新生长的迹象。提示niraparib联合抗pd -1具有持久的抗肿瘤作用。在研究的第65天,观察期结束,所有的无肿瘤小鼠都被接种相同的卵巢癌细胞株。术后7周,没有任何一只接受了联合或单药治疗后肿瘤消退的小鼠出现肿瘤再次生长,提示尼拉帕利单药或联合PD-1抗体治疗都能在BRCA突变的肿瘤模型中建立免疫记忆。总的来说,这些结果证明了niraparib和抗pd -1联合治疗的优势,在brca突变的PDX模型中,具有快速、持久的抗肿瘤作用和潜在的建立免疫记忆的能力。
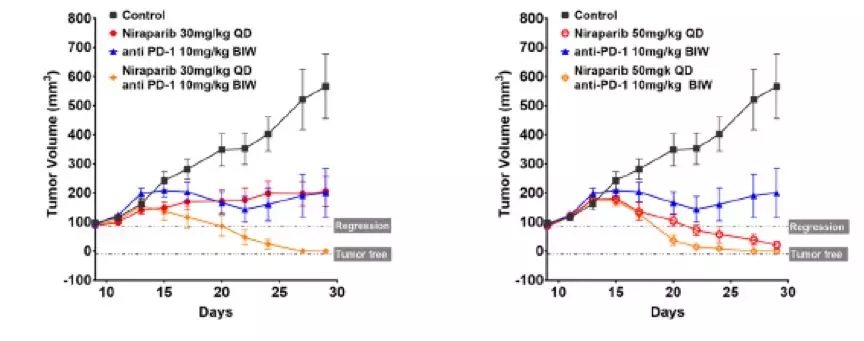
BRCA突变卵巢癌PDX模型中单药和联合治疗组肿瘤体积变化
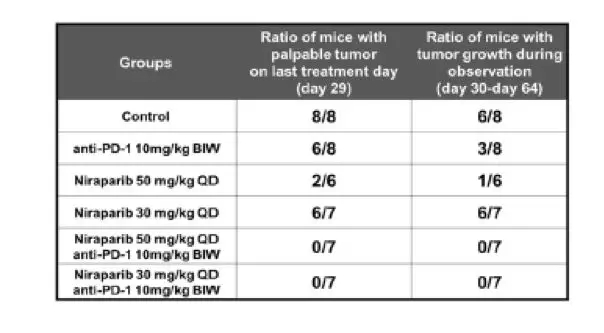
治疗后无药观察期间各组小鼠肿瘤生长的比例
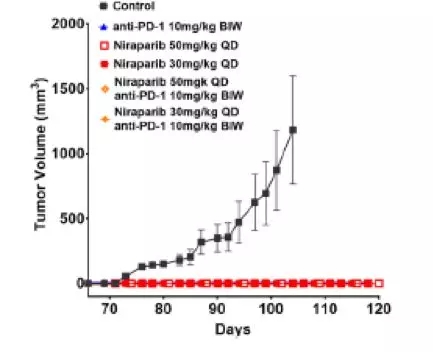
研究第65天后所有的无肿瘤小鼠都被再次接种相同的卵巢癌细胞株与未接种过肿瘤的同鼠龄小鼠相比肿瘤生长情况
Niraparib和抗PD-1抗体在非BRCA突变的PDX模型中显示出协同的抗肿瘤作用
在BRCA突变的肿瘤模型中获得的良好的疗效使研究者有了下一步在非突变肿瘤模型中评估联合治疗疗效的信心。首先在非BRCA突变的皮肤癌PDX模型中进行了试验。该模型对最大剂量抗pd -1抗体和低剂量的niraparib均不敏感,单药治疗时肿瘤生长抑制率分别为11%和16%。niraparib与anti-PD-1联合治疗,肿瘤生长抑制率约为44%,大于两种药物单药治疗的TGI之和,说明niraparib与anti-PD-1治疗存在协同作用。下一步评估了联合治疗在乳腺癌PDX模型中的作用。用两种药物单药治疗的TGI分别为45%和30%。相比之下,在相同剂量下联合使用可显著提高抗肿瘤反应,其TGI为91%。在PD-1抑制剂难治性肿瘤模型中(TP53缺失的肉瘤PDX模型)评估联合治疗的疗效, TGI达到51%,然而任何一种单药治疗都没有观察到对肿瘤的抑制作用。提示尼拉帕利和PD-1抑制剂联合治疗在PD-1抑制剂难治性肿瘤模型中也有协同的抗肿瘤作用。在肺鳞癌PDX模型中,联合治疗也表现出了更好的抗肿瘤作用,TGI达到52%,而尼拉帕利和PD-1抑制剂单药治疗的TGI分别是36%和30%。在结肠腺癌PDX模型,对PD-1抑制剂单药治疗有反应,对尼拉帕利单药治疗无反应,但是,联合尼拉帕利治疗后,肿瘤对PD-1抑制剂的敏感性增加了。联合治疗的获益并不局限于pd -1抑制剂,在niraparib耐药的膀胱癌PDX模型中,niraparib联合pd – 1抑制剂治疗可观察到协同抗肿瘤活性,联合治疗TGI达到66%,而PD-1抑制剂单药治疗的TGI只有10%。提示在尼拉帕利耐药的肿瘤模型中,两药也有协同抗肿瘤作用。总的来说,在多个非BRCA突变的肿瘤模型中,与单药相比,niraparib和PD-1抑制剂联合均有协同抗肿瘤作用。并且,联合治疗协同效应的存在似乎与肿瘤对单药治疗的反应无关。
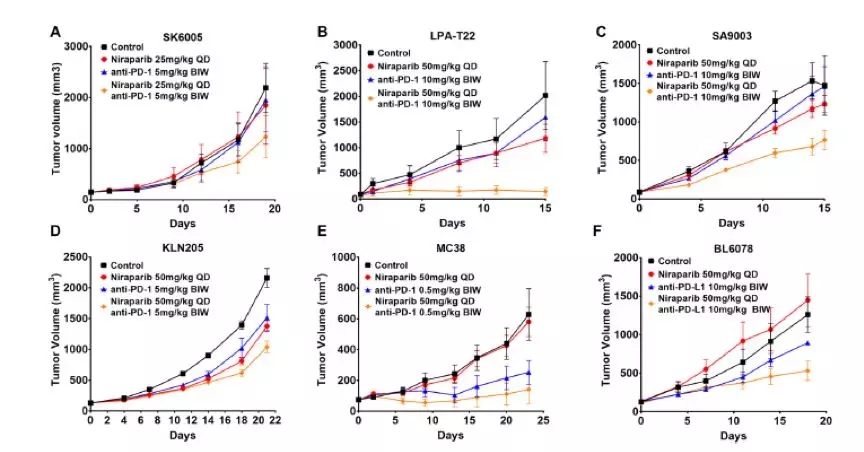
非BRCA突变各癌种PDX模型中单药和联合治疗组肿瘤体积变化
专家点评
这项研究结果使我们对PARP抑制剂的免疫调节功能有了新的认识,并在临床前模型中验证了PARP抑制剂联合免疫抑制剂治疗的潜力。
研究结果显示STING通路活化可能是尼拉帕利免疫调节的机制之一。因此,影响STING通路完整性的因素,比如DNA核酸外切酶Trex1,可能会影响患者对联合治疗的获益。探索STING的作用以及调控STING和IFN信号通路的因素可能会揭示这种联合治疗潜在的获益患者选择的生物标志物。
联合治疗疗效目前仍在临床试验评估阶段,本研究的结果是支持这种联合疗法的。关键的下一步是了解将从这种组合中获益最多的患者群体。据报道,卵巢癌中BRCA突变状态与较高的新抗原出现,T细胞浸润和PD-1表达有关。提示BRCA突变或者HRD的患者更有可能从这种治疗方案中获益,然而,HRD阴性患者的治疗需求仍未被满足,因此,评估PARP抑制剂是否能在临床上诱导这部分患者对免疫抑制剂的敏感性是十分重要的。在II期TOPACIO研究中,尼拉帕利和抗PD-1抗体联合治疗已在包括铂耐药和铂难治卵巢癌患者在内的广泛患者群体中显示出临床效益,更多的机制研究和临床研究将为这种联合治疗方案在更广泛的患者群体中的未来发展提供依据。

扫二维码
关注OC资讯
