近年来,PARP抑制剂在卵巢癌领域的表现值得关注,在铂敏感复发卵巢癌患者的维持治疗有了重大突破,此外PARP抑制剂在复发卵巢癌单药治疗上也有相应的研究如尼拉帕利的QUADRA研究,卢卡帕利的ARIEL2,奥拉帕利的Study42。整体来看,在≥3线的患者中,铂敏感患者ORR约40%,铂耐药ORR约30%左右。但PARP抑制剂也面临很多挑战,如没有同源重组缺陷的患者获益更少,PARP耐药等。免疫治疗在很多领域已经有了突破性的进展,但PD-1/PD-L1单药治疗卵巢癌的疗效欠佳。KEYNOTE-100研究中,Pembrolizumab对复发性卵巢癌的ORR不到10%。PARP抑制剂联合免疫检查点抑制剂是否可行?研究现状如何?未来的方向在哪? 李璡 教授 副主任医师、副教授、博士
复旦大学附属肿瘤医院李璡教授通过2018年12月发表在Cancer research的一篇综述---Development of PARP and Immune-checkpoint Inhibitor Combination,与大家分享PARP抑制剂和免疫检查点抑制剂联合治疗在卵巢癌领域的一些研究进展。
复旦大学附属肿瘤医院妇科副主任医师
负担大学附属肿瘤医院妇科主任助理
中华医学会妇科肿瘤学分会青委会委员
上海医学会妇产科分会青委会委员
《Journal of Gynecologic Oncology》审稿人
 00:000:00 音频
00:000:00 音频
联合机制
1、DDR基因缺陷,如ATM或RAD51导致细胞质DNA的积累,触发STING通路的活化,促进I型免疫反应;同时通过PARP1激活促炎转录因子NF-κB通路。免疫激活会被伴随抑制信号所平衡,包括了PD-L1表达的上调。
2、另一方面,存在DDR缺陷的情况下,DNA损伤无法解决,但维持在非致命的水平,结果形成一个自我维持的循环DNA损伤和慢性炎症环境,需要药物联合才可能解决。
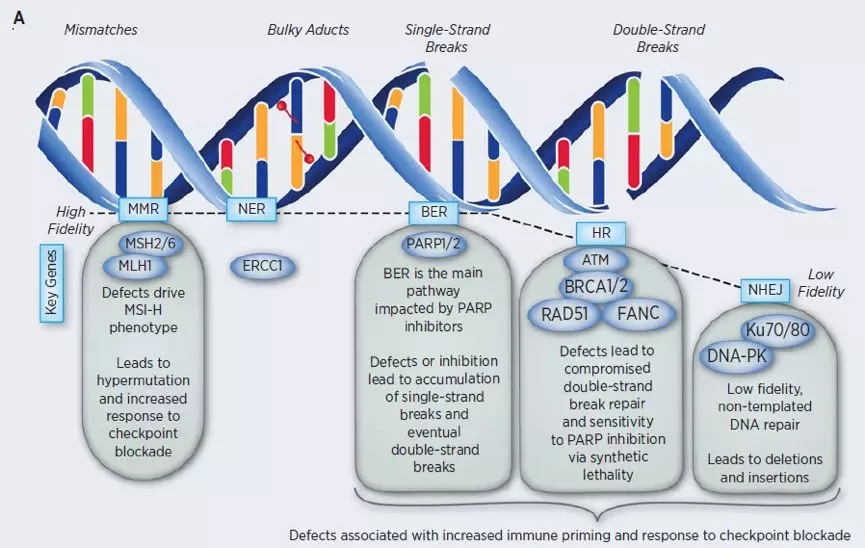
图A:主要DNA损伤修复途径:错配修复(Mismatch repair, MMR); 核苷酸切除修复(nucleotide excision repair , NER); 碱基切除修复( base excision repair, BER); 同源重组修复( Homologous recombination, HR); 非同源末端链接(Non-homologous end joining, NHEJ)
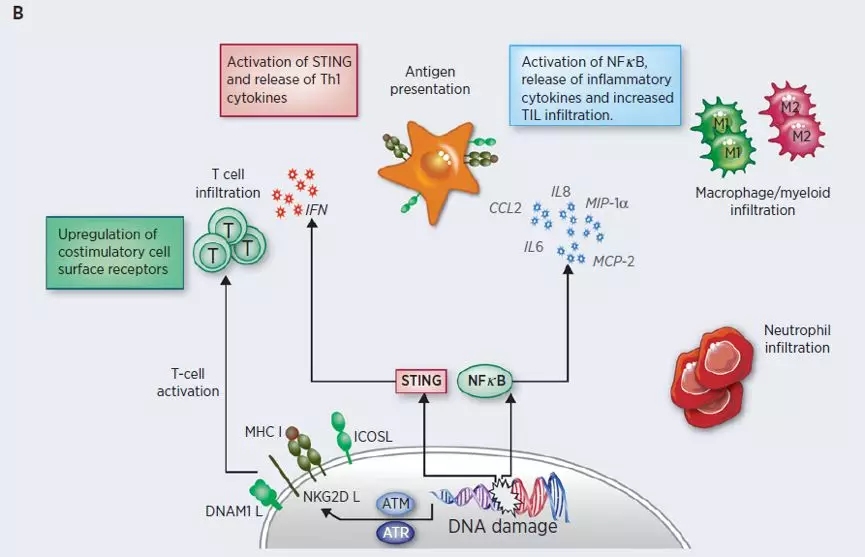
图B:DNA损伤通过激活STING和NF-kB通路促发细胞外源性免疫反应, 引起促炎信号释放并增加免疫细胞浸润。MHC上调和共刺激因子增加肿瘤细胞内源性免疫原性,增加T细胞对肿瘤细胞的识别
研究汇总
基于以上机制,多项I/II期和III期研究均在进行中,如尼拉帕利针对一线治疗的FIRST研究,卢卡帕利针对一线维持的ATHENA研究,针对复发维持的有尼拉帕利ANITA研究。对于复发治疗,目前有奥拉帕利MEDIOLA和尼拉帕利的TOPACIO研究。
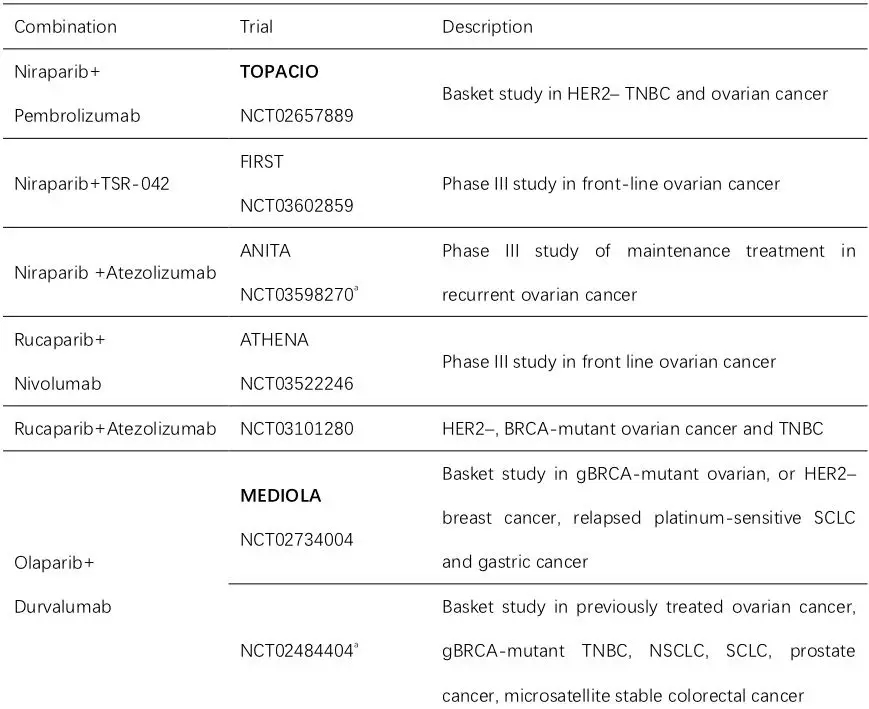
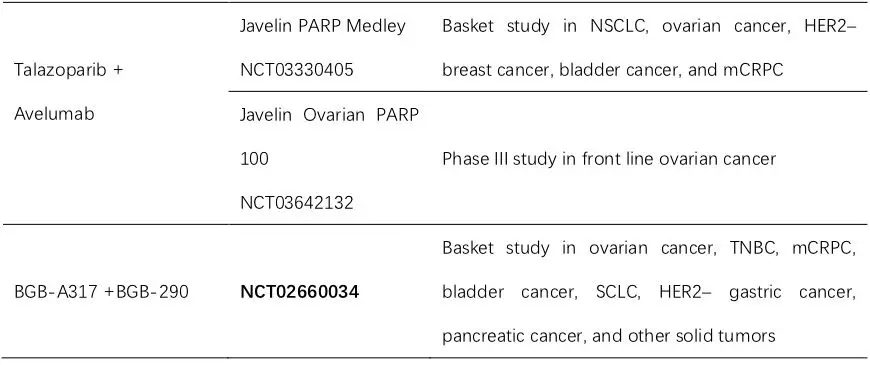
目前为止,MEDIOLA研究和TOPACIO研究的结果均显示PARP抑制剂联合免疫检查点抑制剂能达到1+1>2的效果。与MEDIOLA研究纳入的是铂敏感复发且gBRCAmut的患者不同,TOPACIO研究更具挑战,全部纳入铂耐药或继发铂难治患者,尼拉帕利联合Pembrolizumab,ORR约25%左右。亚组分析显示,不论患者BRCA突变或者HRD状态,各亚组缓解率是相似的。整体人群的中位DOR达到9.3个月。这个研究提示尼拉帕利联合Pembrozumab的优势在于不论患者BRCA突变状态如何,均能从这个联合治疗中获益。
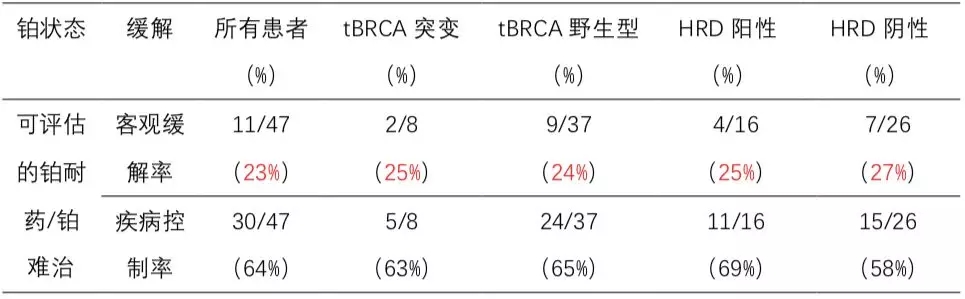
表1:topacio研究结果
不良反应
联合治疗会不会带来更多副反应呢?以上两个研究的不良事件和两个单药类似,没有新的不良反应出现。如MEDIOLA研究中,≥3级贫血发生率为12%,TOPACIO研究,尼拉帕利RP2D的推荐剂量为200mg, ≥3级血小板降低的发生率仅9%。BGB-A317/BGB-290肝脏毒性发生率有所升高,这提示不同的PARP抑制剂和免疫检查点抑制剂的联合可能会有不同的不良反应谱,临床未来使用中药物间替换需谨慎。
专家点评
1、现有研究的终点大多基于早期终点如ORR。没有DDR缺失的患者,PARP抑制剂获益相对少,对于这部分患者反应率或许是比较有意义的临床终点。但在获益很大的有BRCA突变人群,联合治疗或许应考虑采用DOR或提高的生存作为长期获益的观察指标。
2、认识和理解联合治疗中biomarker的功能和相互作用也至关重要。从组织标本和血液标本不但要获得DDR缺失的信息,还需探索更深层的问题如多少基因突变?哪些基因突变?杂合子还是纯合子突变?体系突变是早期或晚期?将TCR测序,PD-L1表达谱,CD8T细胞浸润,广泛免疫浸润等信息综合,找到DDR和免疫治疗的相关点,就能帮助我们理解DNA损伤和抗肿瘤免疫治疗机制之间的联系。
3、此外,监测和观察联合治疗疗效的指标也是巨大的挑战,ctDNA可能是一个潜在的标志物。
总而言之,PARP抑制剂联合免疫检查点抑制剂在卵巢癌中已显示初步的疗效,期待后续临床研究带给我们更多疗效和安全性数据。PARP抑制剂等传统化疗以外的新疗法在卵巢癌领域现在是小荷才露尖尖角,未来还会有更广泛的探索,例如PARP抑制剂与抗血管生成药物联合,PARP抑制剂,抗血管生成和免疫治疗的多药联用等等,我们期待未来卵巢癌的治疗模式会有巨大的进展和变革。

扫二维码
关注OC资讯
